
気体・溶液・物質の三態の記事まとめ
<このページの内容と対象>:高校化学(理論分野)でも、とくに難しく感じやすい【気体〜(希薄)溶液〜状態変化】が苦手or独学する人向けに、豊富なイラスト・イメージを用いながら解説した記事のまとめページです。
(随時追加・更新中です。)
目次(タップした所へ飛びます)
気体分野と状態変化(高校化学)
まずは初めに気体分野+次の項での”溶液”とも関連する『状態変化』をまとめていきます。
理想気体の”状態方程式”とボイル=シャルル
気体分野の1記事目は何と言っても「”状態方程式+ボイル=シャルルの法則”をまとめて解説!」です。
理想気体とは、気体の分子そのものの体積を考慮せず(体積を含めると、V変化してしまいます)、分子の間に働く”ファンデルワールス力”の影響を受けない(同じく、Pが変わってしまう)状態の”気体”のことです。
対して、これら2つを勘案したものが”ファンデルワールスの(実在気体の)状態方程式”と言われるものです。【これについては現在別記事を作成中です。】
気体の比例・反比例のグラフから正しいものを選ぶ問題
次に、状態方程式・ボイル=シャルルの法則をうまく活用して、以下の図のようなグラフから”正しいものを選び出す”という超頻出+重要な問題の解法を→「正確なPV,VT,PTの比例/反比例グラフの選び方」で紹介しました。
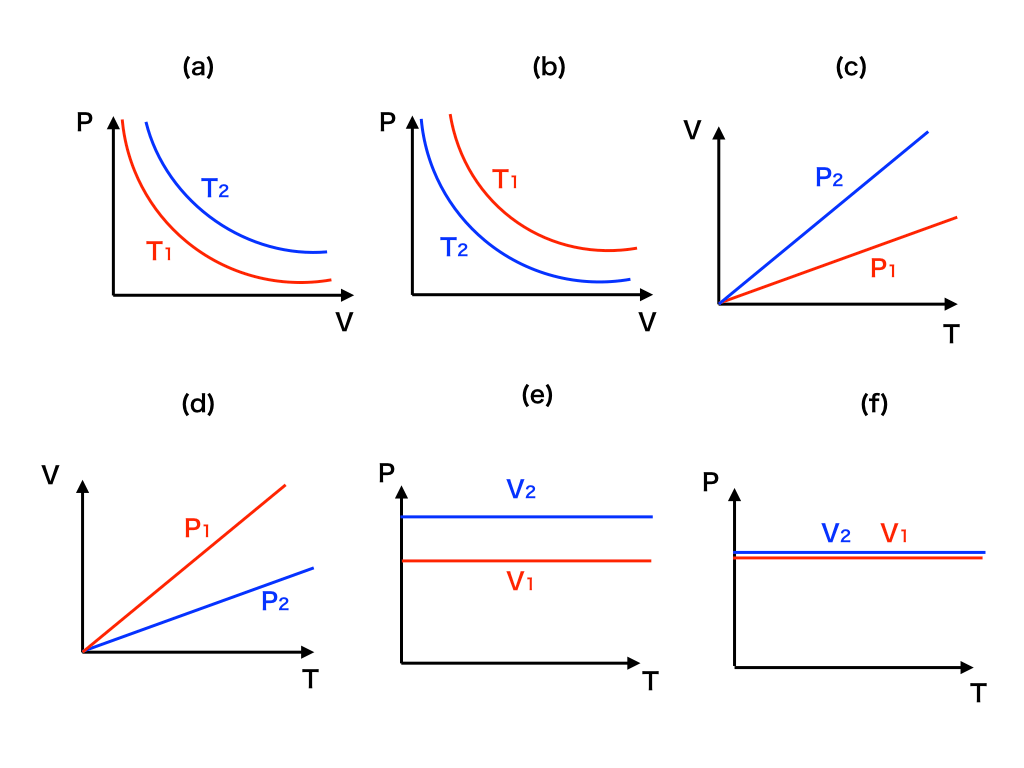
<問題例↑>
状態図と蒸気圧曲線
いわゆる『状態図』・『蒸気圧曲線』の読み取り方と注意事項をまとめた記事です。「状態図と蒸気圧曲線の意味と見方」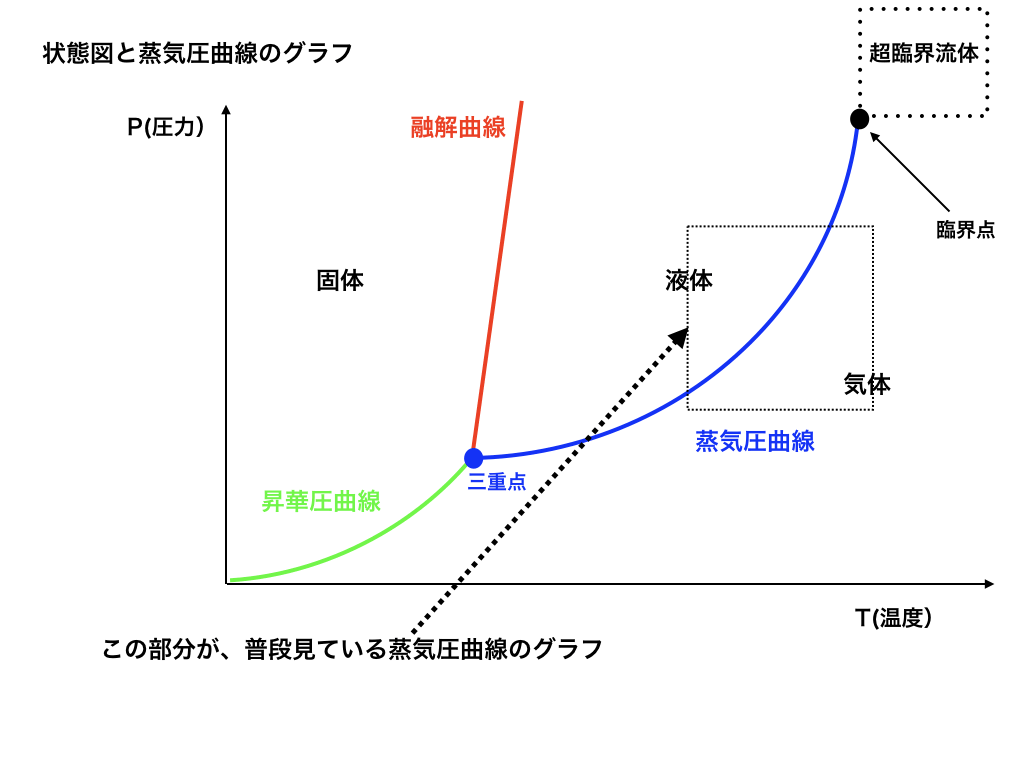
物質の3態「気・液・固」と状態変化
これは次の”溶液”とも一部重複しますが、「気体/液体/固体の物質の状態変化」について要点を整理しています。
沸点上昇・蒸気圧降下と凝固点降下
この辺りから特に難しく感じてしまう人が増えてきます。
逆に差をつけることが出来るところでもあるので、「沸点”上昇”+蒸気圧”降下”+凝固点”降下”をイラスト付きでわかりやすく紹介」この記事でぜひ得意分野に変えてください。
溶液(化学/化学基礎)
溶液・希薄溶液分野もややこしかったり、理解しにくいものが多いです。
3種類の”濃度”の違いと計算法
これは溶液だけにとどまりませんが、「化学で登場する3つの”濃度”の単位・計算・意味」を知っておく+自由に計算し、相互に変換できるようになっておかないと次に進めません。
この記事では、”mol濃度”、"質量%濃度"、"質量mol濃度"のそれぞれを詳しくまとめました。
浸透圧の意味と求め方
浸透圧は比較的理解しやすいですが、実は奥が深いです。「浸透圧の公式と定義、分子量の測定への応用まで」の記事で、具体的な求め方である”ファントホッフ”の公式と3つの定義+有機化学でも重要となる分子量の測定への応用を詳しく解説しました
冷却曲線と熱量計算のコツ
溶液を徐々に冷却していったときに起こる【特徴的な温度変化をグラフ化】した「冷却曲線の読み方+注意点まとめ」は、それぞれ注目するpointがあります。
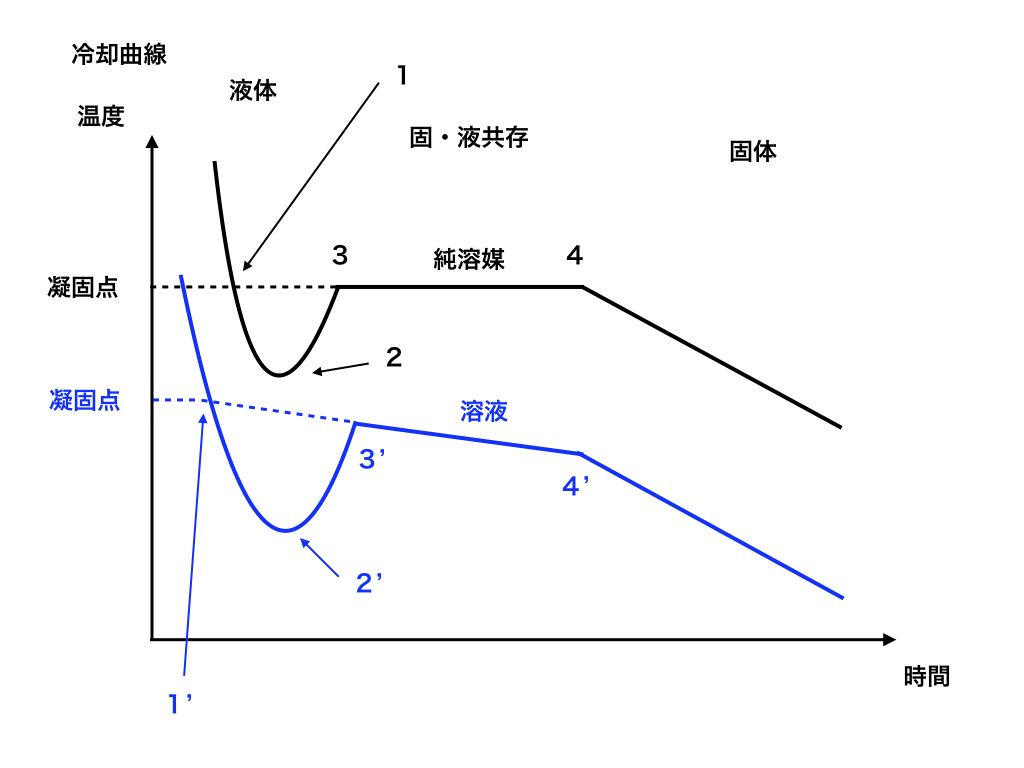
更にそれぞれの理由を答えさせられる事も多いので、丸暗記ではなく”理屈”の部分と合わせて理解するようにしましょう。
併せて読みたい記事一覧(平衡/酸塩基)
気体や溶液の知識を使って『化学平衡』や酸・塩基分野の問題を解く事も多いです。参考用にそれらをまとめておきます。
〜平衡分野〜
『反応物⇔生成物』の反応速度が釣り合った場合、(あくまで見かけ上)化学変化が止まっているような状態になります。
それを【平衡状態】と呼び、この項ではそのそれぞれの種類の記事をまとめています。
「Kp(圧)平衡定数とKcとの関係」(化学平衡の中でも、気体の圧力に注目したKpを解説しています)
〜酸と塩基〜
溶液のpHについても、少し発展問題になると『対数』の基礎知識が必要です。未習の人でも理解できるよう簡単に『log』の扱い方も紹介しています。
強酸や強塩基ならば上の方法でpHを求めることが出来るのですが、そうでない場合、平衡の中でも『電離平衡』の考え方を使う必要が出てきます。
記事で理解した内容を演習
「化学・化学基礎のおススメ演習本(参考書)3選+α」←各記事で基本的な内容と例題を理解したら、良質な問題集で頭に定着させる必要があります。
上の記事では、それぞれのレベルの大学・学部合格のために“必要十分”な3つの問題集と参考書に絞って紹介しています。
・・・(続く)・・・
”学習・受験メディア”:スマホで学ぶ(独学する)サイト『スマナビング!』では読者の方からの「ご意見」、「ご感想」をコメント欄にて募集しています。
(※):現在時期的な問題で、個々の問題のご質問については対応できない場合があります。
(誤植の指摘や、ご感想は引き続き募集しています。)
・お問い合わせ/ご依頼等、その他のご連絡については、【運営元ページ】よりお願いいたします。

