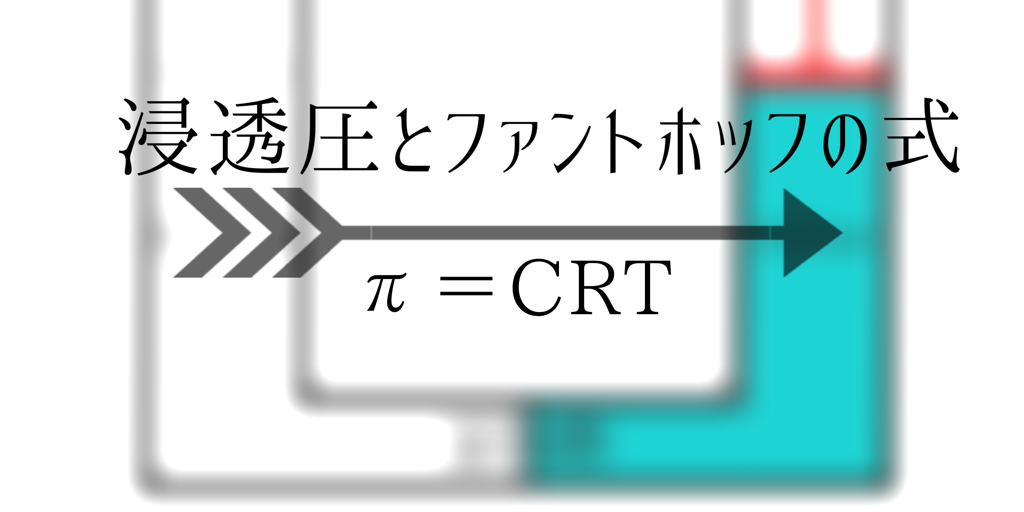
浸透圧とファントホッフの式
今回は高校化学、理論分野の溶液から、
・浸透圧の解説とファントホッフの式の使い方
・モル濃度の計算に必須の電解質・非電解質、電離度αの解説を行います。
浸透圧は、生命と深く関わるので医歯薬系の大学や学部の入試問題でもよくテーマになります。
これらの大学を目指している人は、特に対策をしておく必要があります。
目次(タップした所へ飛びます)
浸透圧とファントホッフの式
・はじめに「用語の確認」
・浸透圧とは
・モル濃度と電解質・非電解質
・電離度α
・ファントホッフの式
・例題
・まとめ
用語の確認(溶媒、溶質etc,,,)
浸透圧の解説に入る前に、間違えやすい言葉の確認をしておきます。
溶媒:他の物質を溶かすものです(例:水H2O,有機溶媒ジエチルエーテルC2H5OC2H5など)
(参考)電気陰性度と電子式で極性と分子の立体構造がわかる方法
溶質:溶媒に溶けるもの。
溶液:溶液=溶媒+溶質です。
これについて詳しくは>>「mol濃度・質量パーセント濃度・質量mol濃度を徹底解説!」をご覧ください。
浸透圧とは
濃度の違う二つの溶液を、「半透膜」とよばれる『溶媒分子のみ通過させる膜』で仕切ったときに、
二つの溶液の濃度を均一にするために溶媒分子が濃度のこい方の溶液に侵入します。
この溶媒分子が侵入する圧力と同じ値で、移動をじゃまする圧力を浸透圧と言います。
ほかにも半透膜を押す圧力ともおなじ値を示します。
ファントホッフの式
ファントホッフの式は、浸透圧を計算するための式で、浸透圧をπ(Pa)、モル濃度をC(mol/L)、Rを気体定数:8.31・10^3(Pa・L/K・mol)、
Tを絶対温度(K)として、以下の様に表されます。
π=CRT
ここでモル濃度C=n(mol)/V(L)であることに注目すると、ファントホッフの式は
πV=nRTという風にも表す事ができます。
これは、気体の状態方程式PV=nRTとソックリですね!
→<参考>「理想気体の状態方程式をマスター」
この式の形で使うこともあるので、変形できる理由とともに覚えておきましょう。
\(\begin{aligned}\pi =CRT\\
\left( C=\frac {n}{V}\right) \end{aligned}\)
モル濃度と電解質・非電解質
浸透圧は上記の様に、『ファントホッフの式』で求める事ができるのですが、式中に溶液のモル濃度を代入する必要があります。
溶液中の溶質が非電解質(水に入れて電離しない物質:グルコースなど)の時は、
溶媒に入れる前のモル数=溶媒に入れた後のモル数が同じなので、単純に溶質の物質量(mol)/溶液の体積(V)で計算できます。
しかし溶質が電解質(水中で電離してイオンになる物質:NaCl食塩や、H2SO4硫酸など)
だとモル数が溶媒に入れる前の物質量(mol)と溶媒に入れた後の物質量がことなってきます。
例えば、HClは電離してH+とCl-となるので、とかしたHClの2倍のmol数でモル濃度を計算します。
硫酸:H2SO4は同様に電離してH+2つとSO4ー1つになるので、とかす前のH2SO4の3倍のモル濃度で計算します。
この二つは強酸なので、この様に計算出来ることが多いですが、
弱酸や、弱塩基の場合には以下で説明する電離度も計算に影響してきます。
電離度α
電解質は溶媒中で電離する物質ですが、全ての種類の電解質が100%電離するわけではありません。
どのくらい電離するかを電離度αで表し、その値は0≦α≦1を取ります。
$$\alpha =\frac {\left( 電離した物質量\right) \left( mol\right) }{\left( 投入した物質量\right) \left( mol\right) }$$
αが大きいほど多くの分子が電離します。いわゆる「強酸」や「強塩基」はαがほぼ1=100%電離します。
一方で弱酸や弱塩基は、強酸や強塩基よりかなり小さい値をとります。
<参考:「弱酸・弱塩基のpH(水素イオン指数)の求め方」>
αは他にも溶液の濃度や温度に影響を受けますが、それについては電離平衡の記事で触れようと思います
この電離度のは先ほどの『ファントホッフの式』の、C=n/Vを計算するときに代入するn(mol)に使います。
ファントホッフの式を使いこなす
ここからは例題を通して、今回の内容を確認していきます。
電解質の浸透圧を求める
(例題1)2.0molのNaClを溶かした溶液1Lの浸透圧を求めよ。
但しNaClの電離度α=1とし、気体定数R=8.31×10^3(Pa・L/K・mol)、温度は27℃であるとする。
(解答1)これは、単純にファントホッフの式に代入するだけです。
注意点は、
・電離度α=1なのでNaClはNa +とClーの2倍のmol数になることと、
・27℃は摂氏なので、絶対温度ケルビン(K)に変換するだけです。
従って、\(π=(2.0・2)・(8.31・10^{3})・(273+27)\)
よって浸透圧は\(9.97\times 10^{6}\left( Pa\right) \)
【有機構造決定で頻出】浸透圧から分子量を計算する
(例題2)分子量がわからないタンパク質(非電解質)25.0gを水にとかして1Lの溶液を作った。
この溶液の浸透圧が17℃で1.0・10^3(Pa)であるとき、このタンパク質の分子量を求めよ。
ただし気体定数R=8.31・10^3(Pa・L/K・mol)とする。
(解答2)この例題のように、浸透圧から逆算して分子量を求める問題は有機構造決定の際に行うこともあります。
$$手順は、C=\frac{n}{V} 更にn=\frac{w}{M} $$
(wは質量/Mがモル質量)である事から、
$$C=\frac {n}{V}=\frac {1}{V}\times \frac {w}{M}$$
\(π=1.0\times 10^{3}=\frac{n}{1L}×(273+17)・(8.31・10^{3})\)
$$とn=\frac{25}{M}より、式を整理して$$
M=60247.5(g/mol)
よって、このタンパク質の分子量はおよそ\(6.0×10^{4}(g/mol)\)
上の記事↑でここで求めた分子量を使って、有機化合物を決定する方法(手順一)を紹介しています。
続編出来ました!<溶液範囲が苦手な人必見です!>
今回学習した内容は、浸透圧だけでなく他の溶液の分野(沸点上昇、凝固点降下etc...)や、
電離平衡など幅広いジャンルで利用するのでよく復習・問題演習しておいて下さい。
(復習用:「化学・化学基礎のオススメ演習書」)
溶液シリーズ
第一回:「今ここ」
第二回:「状態図の見方と蒸気圧曲線の読み取り方」
第三回:「蒸気圧降下と沸点上昇/凝固点降下の関係と仕組みが分かる」
第四回:「冷却曲線と水和物の扱い方が得意になる」
NEW「気体と溶液・希薄溶液の分野を総まとめ!」<<関連記事のまとめページです。ぜひ参考にしてください。
今回もご覧いただき有難うございました。
お役に立ちましたら、シェア&当サイト公式Twitter(@linkyjuku_tweet)のフォローをお願いします!
質問・記事について・誤植・その他のお問い合わせはコメント欄までお願い致します

