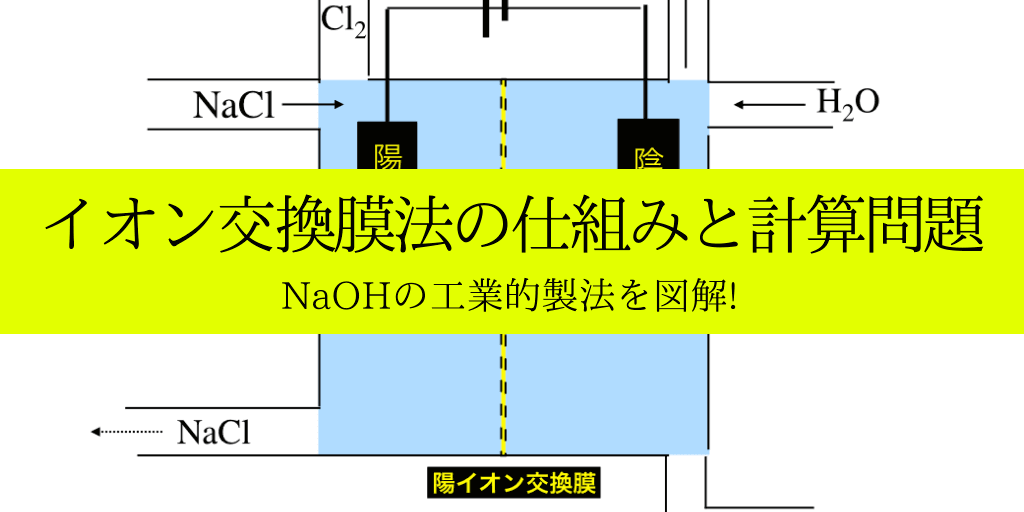
NaOHの工業的製法
イオン交換膜法(水酸化ナトリウムの工業的製法)の仕組みや構造などを、電気分解の復習を行いながら図解していきます。後半では、具体的な計算問題を用意しています。
目次(タップした所へ飛びます)
陽イオン交換膜法とは
電気分解と「陽イオン」のみ通過させることができる膜:「陽イオン交換膜」を用いて【NaCl】と【水】というありふれた物質から、水酸化ナトリウムを製造する方法です。
水酸化ナトリウムと原料
・NaOHはソーダ工業と、あらゆる化学工業において使用される超重要物質です。
原材料は上述したとおり\(\mathrm{H_{2}O、NaCl}\)
関係のある「ソルベー法(炭酸ナトリウムの製法)」とともにしっかりおさえておきましょう。
その他の製法
隔膜法という方法(イオン交換膜の代わりにアスベスト:石綿を用いるもの)や、水銀法(水銀を用いるもの)が以前は盛んでしたが、ご存知の方も多いように石綿・水銀の健康被害や効率性の面から課題が多く、今は殆ど行われていません。
イオン交換膜法の仕組み
以下の模式図のような仕組みでNaOHを効率的に製造します。
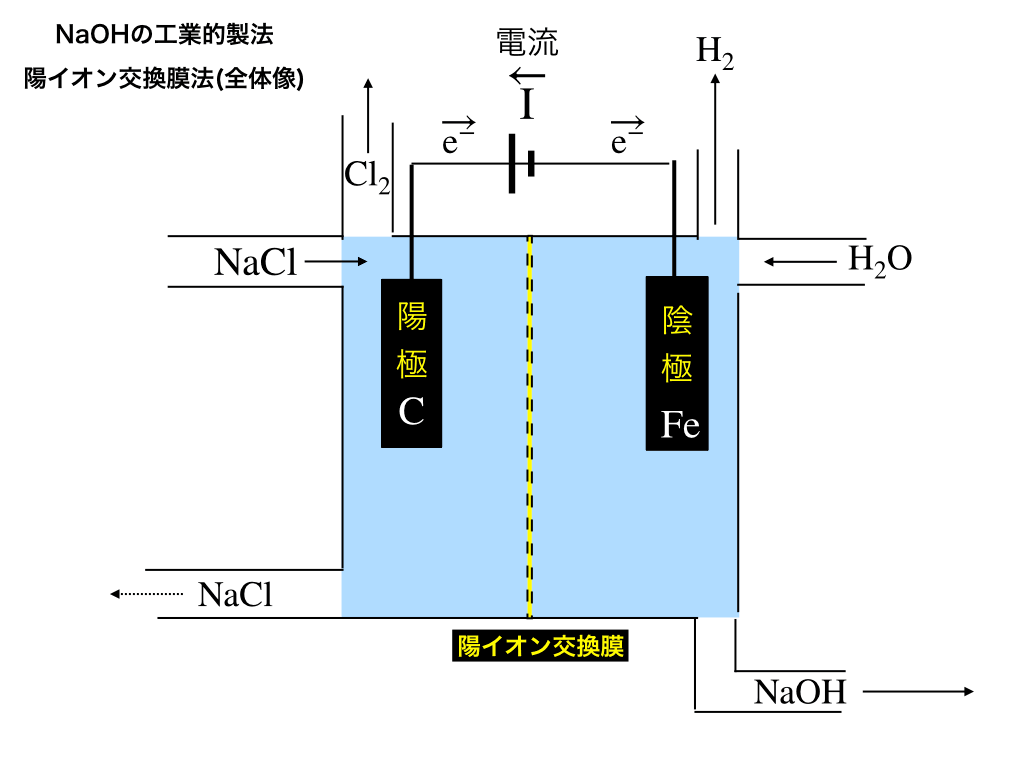
・陽極板は炭酸棒
・陰極板には鉄を使います。
交換膜を通る/通らないイオン
さて、この交換膜法のキモとなる【イオン交換膜】とはどの様なものが簡単に確認しておきます。
通るイオン:\(Na^{+}\)
通らないイオン:\(Cl^{-}、OH ^{-}\)
\(\mathrm{NaCl\rightarrow Na^{+}+Cl^{-}}\)
\(\mathrm{H_{2}O\rightarrow H^{+}+OH^{-}}\)
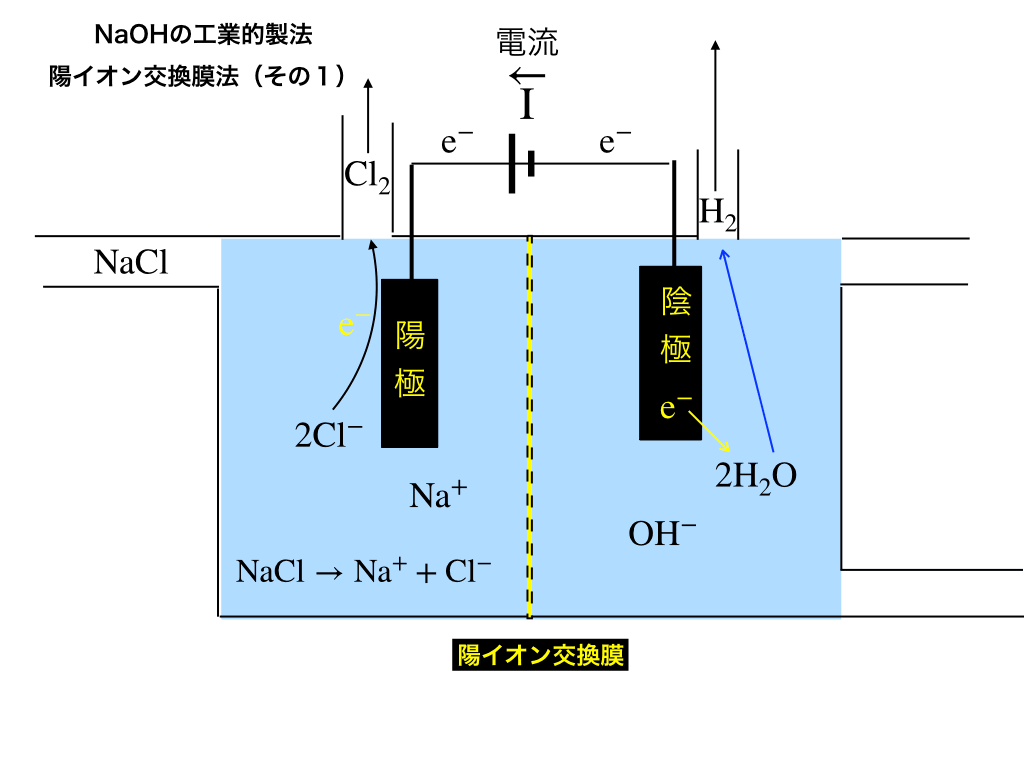
陽極側での反応
NaClから電離した\(Cl^{-}\)から(電気分解により)無理矢理電子を奪って酸化させ、塩素ガスが発生します。
塩素↑\(\mathrm{2Cl^{-}\rightarrow 2e^{-}+Cl_{2}↑}\)
さらに、残されたナトリウムイオンは陽イオンなので、交換膜を通過でき陰極側で反応を起こします。
陰極側での反応
陰極側では供給される水に電子を渡し(=還元)て、水素と水酸化物イオンが生じます。
水素↑\(\mathrm{2H_{2}O+2e^{-}\rightarrow H_{2}↑+2OH^{-}}\)
陰極側での(最終的な)生成物
\(\mathrm{Na^{+}+OH^{-}\rightarrow NaOH}\)
最終的に、交換膜を通過してきたNaイオンと水酸化物イオンが反応してNaOHができます。
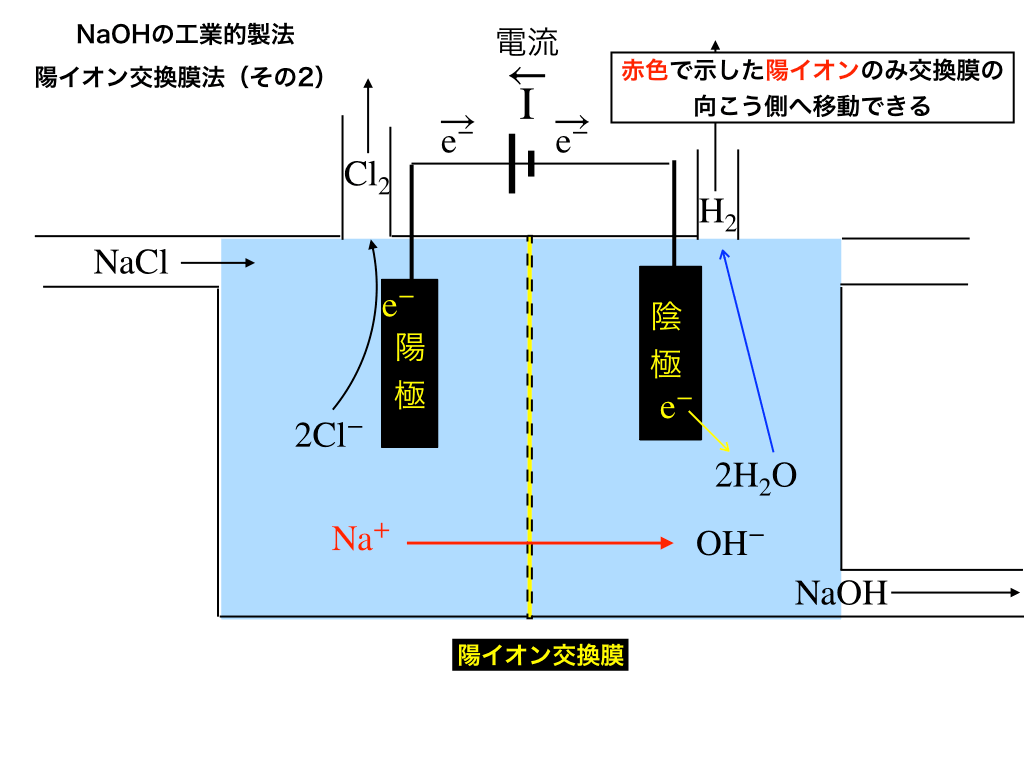
→ここでできる【NaOH水溶液】をさらに濃縮する作業を行なって一連の製法が終了します。
まとめ
全体の反応式は、以下のように書くことができます。
\(\mathrm{2H_{2}O+2NaCl\rightarrow H_{2}+Cl_{2}+2NaOH}\)
水酸化Naの工業的製法の計算問題
入試などでは、前半部分でイオン交換膜法の仕組み(と、場合によっては無機分野の知識)を問い、後半で電気分解を絡めた計算問題が出題されることが多いです。
ファラデー定数などの取り扱いが不安な人は↑の記事などで先にチェックしておきましょう。
電気分解の問題
図のイオン交換膜を用いて、2.5(A)の電流を32分10秒間流し続け水酸化Naを作る。
この時標準状態のもとで、陰極で発生する気体の体積(L)とNaOHの質量を求めよ。
ただし、F=96000(C/mol)とする。
解答解説
一応確認ですが、A(アンペア)×s(秒)=C(クーロン)なので前準備として分秒を秒に統一します。
\(32\times 60+10=1930\)
ここで、電気分解や電池の問題を解く時に注目するのは【電子】です。
この電子\(e^{-}\)を基準にすれば、大抵の問題は解くことができます。
陽極と陰極でのイオン反応式(の係数:特に電子)と全体の反応式を考えると、2つの\(\mathrm{NaClとH_{2}O}\)から2つのNaOHが生成され、発生する水素と塩素の係数は“1”となっています。
この時やりとりされている電子はNaCl、NaOH、水と同じ、\(\mathrm{Cl_{2}、H_{2}}\)の倍なので、(*)
32分10秒間に流れた電気量をファラデー定数で割り(=電子をmol換算する)、(*)のモル比から
$$\mathrm{\frac{2.5\times 1930}{96500}\times \frac{1}{2} \times 22.4=0.56(L)}$$
故に、塩素ガスが0.56L発生し、
$$\mathrm{\frac{2.5\times 1930}{96500}\times 1 \times 40=2(g)}$$
同様に計算を進めるとNaOHが2(g)生成されます。・・・(答)
NaOHの陽イオン交換膜法まとめ
・陰極側・陽極側での反応式をまとめ
・簡単な図を描いて理解を固めていきましょう。
工業的製法一覧と関連記事へ

