
電気陰性度と分子の形、極性
皆さんは、水分子が折れ線型でアンモニアが三角錐型で、〇〇はーーと暗記してしまって居ませんか?
電気陰性度と電子対の考え方を使えば、極性の有無や分子の立体構造、更に水に溶けるのか、有機溶媒に溶けるのかetc...を暗記せずに済みます。
目次(タップした所へ飛びます)
電気陰性度と極性そして分子の形
・電気陰性度のおさらい
・極性とは
・極性分子と無極性分子の見極め方
・極性/無極性分子の性質とその理由
・極性の有無で分子のカタチを推定する方法
電気陰性度とは
先に電気陰性度の詳しい解説「電気陰性度って何?電子親和力やイオン化エネルギーとの関係」を読む
電気陰性度とはいわば「電子大好き度」=「相手の電子を引っ張って、自分の電子殻に電子を入れる事で希ガス配置になりたい度=安定したい度!」でした。
そして、<図1>を見ると分かりますが、周期表の右上に行くに従ってその値が大きくなっていきます。特に、F、O、Nは電気陰性度の値が非常に大きいです。
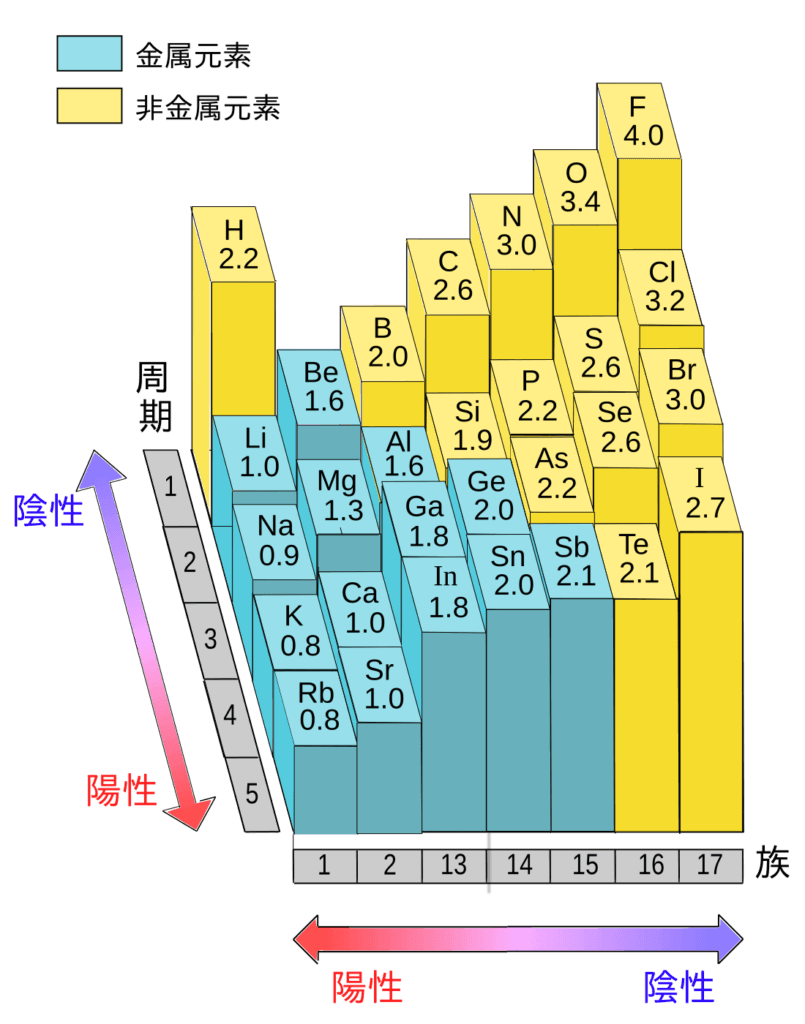
<図1>
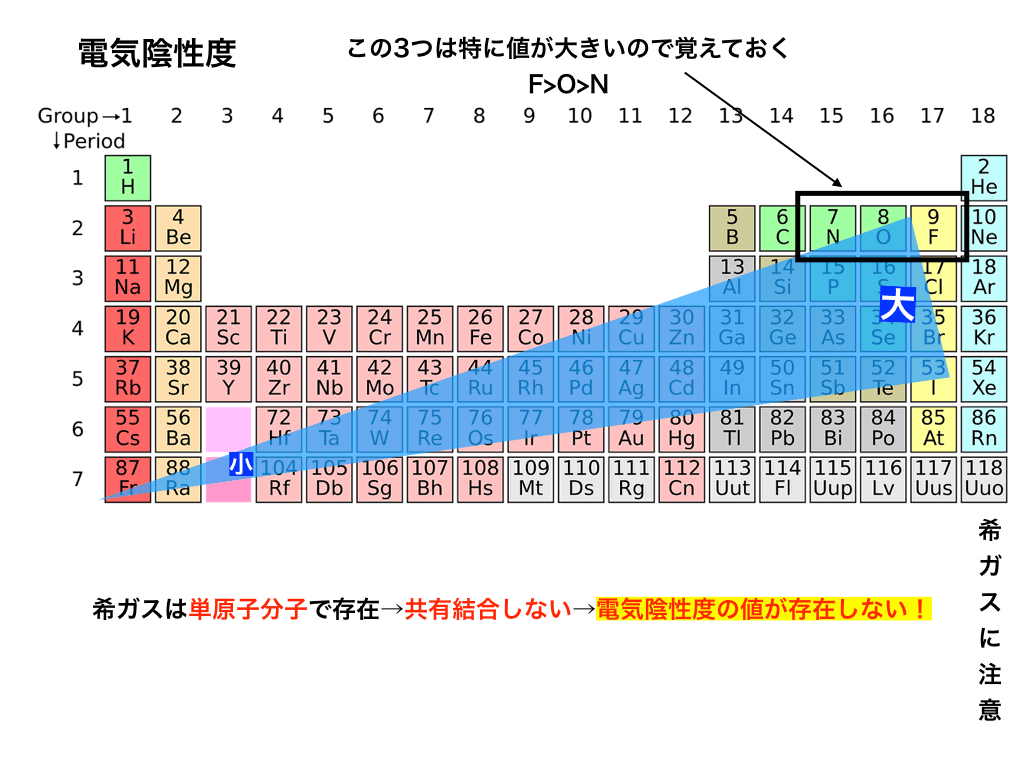
注意点は、希ガスは既に安定した電子配置を取っているので電子を必要としない +電気陰性度が定義されていない点です。
電気陰性度をもう少し詳しく→「電気陰性度/電子親和力/イオン化エネルギーの違い」を読む
極性とは
極性とは、電気陰性度の値が異なる原子同士が結合して分子を作った時に生じるものです。
電気陰性度の値が大きい原子の方へ「共有電子対」が引っ張られ、分子中にわずかな電荷のかたより
(わずかに負に帯電している時δー、正に帯電している時δ +と書きます)がある状態を言います。(δはデルタと読み「わずかに」といった意味合いです。)
極性分子と無極性分子の見極め方
基本的には、電気陰性度が異なる原子でできた分子は極性分子で、同じ原子で構成された分子は無極性分子です。
但し、構成する原子が異なっていても、分子の立体構造によっては無極性分子である事がよくあり、試験でもここを問われることが多いです。
例えば、メタンCH4は正四面体であり<図2>の様に極性を打ち消しあいます。
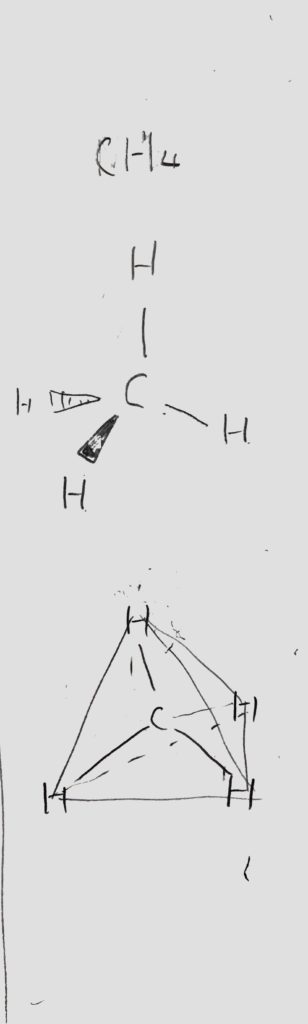
<図2:メタンが無極性分子の理由>
また二酸化炭素CO2は、O=C=Oと二重結合でCとOが強く結びついているので回転出来ず、結果として、一直線上にO=C=Oと並びます。
電気陰性度の値はO>Cなので、Cの共有電子対は左右共Oに引っ張られます。
が、しかし分子を全体で見ることで、O←C→Oとうまく左右で打ち消しあっている事がわかります。
従ってCO2も無極性分子です。
電子の反発と分子の形(立体構造)
電子は負の電荷を持っているので、電子対は反発し合い、なるべく離れた配置(角度)を取ろうとします。
そのもっとも電子対が離れた構造(配置)は、分子の電子式によって異なります。
ここでは中心の原子が共有/非共有電子対合わせて4つ持つ分子を考えてみます。
折れ線型(水など)の分子と電子
水分子H2Oを見てみましょう。
水分子中の酸素O原子の電子に注目すると、水素原子H2つと電子対を共有し、残りの非共有電子対2組が残されます。
そこで、まず正四面体の中央にOを置きます。
そして、H2つが最も離れた配置(正四面体の頂点の内2つ)で、残った2つの非共有電子対を正四面体の頂点に置くと<図3>の様になります。これはいわゆる「折れ線型」ですね。
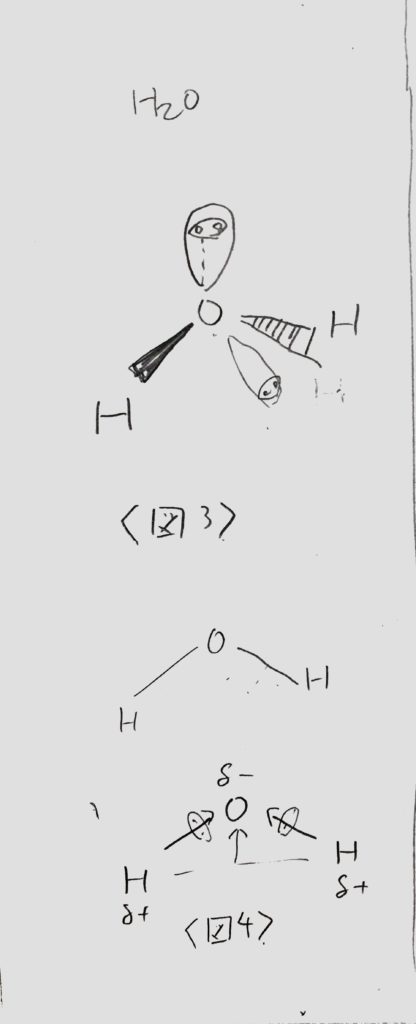
<図3>及び<図4:水分子が極性を持つ理由>
電気陰性度の差から、H→O←Hとなりますが、立体構造がCO2と異なります。
二重結合がなく、一直線ではないので、右上向きベクトルと左上向きベクトルを合成した、<図4>の様な【少し上方向の】極性が出来ます。
ここまで、水分子、メタン分子、二酸化炭素分子、と見てきました。それぞれ折れ線型、正四面体型、直線型、でした。
三角錐型(アンモニアなど)の立体構造と電子
もう一つ入試頻出の型が、アンモニアNH3に代表される「三角錐型」です。
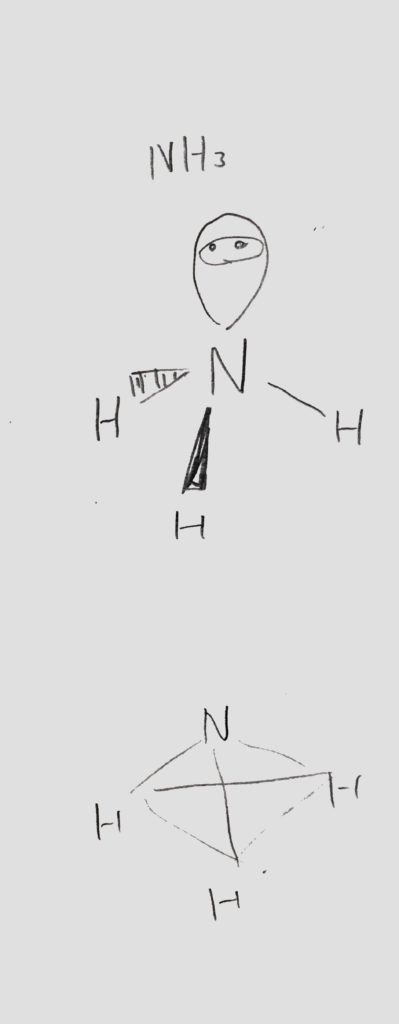
<図5:アンモニアの分子の形と電子対>
まずNを正四面体の中心に置いて、残りのHを正四面体の三つの頂点に置きます。
この時点でNは非共有電子対を1つ持つので、それを残った正四面体の残り一つの頂点に配置することにします。
そうする事で、電子対はそれぞれ最も離れた状態になり、アンモニア分子は三角錐の形をとります。→<図5>
電気陰性度は、N>Hより、3方向の水素原子の共有電子対を窒素原子が引っ張ります。
これも、立体配置で見ると打ち消さないので極性を持っていることになります。
ここでは、中心の原子が共有/非共有電子対を合わせて4つ持っている分子の形を紹介しました。
この他にも電子対の数によって、三角形型など色々な種類がありますが、共通する事は電子対が出来るだけ離れる配置を取るという事です。
極性分子と無極性分子の性質
この記事の最後に極性/無極性分子の性質の違いについて触れたいと思います。
・最大の特徴は水/エタノールに溶けるor有機溶媒(ベンゼン、ジエチルエーテル他)に溶ける
極性分子は極性を持つ水に溶けやすく、無極性分子は有機溶媒(ジエチルエーテル、ベンゼンなど)に溶けやすいと言う性質を持ちます。
これは、有機化学の分離などでもよく使う事柄なので、是非覚えておきましょう。
極性と分子の立体構造まとめ
・極性が出来る主な原因は、その分子を構成する原子の電気陰性度の値の差である
・但しその分子の立体構造によって極性が打ち消される事がある
・分子の立体構造の形を推定するには、共有電子対と非共有電子対がそれぞれ”もっとも離れる”為にどの様な構造を取れば良いかを電子式で考える。
・例)H2OはOを正四面体の重心に置いて、非共有電子対2組とH原子2つを各頂点に置くことで、折れ線型に見える。
・極性分子は極性溶媒に、無極性分子は無極性溶媒に溶けやすい。
今回の内容はいずれも基礎的な事ですが、今後有機化学や複雑な理論化学の問題を解く際に必ず役に立つので、是非復習しておいて下さい!
電気陰性度の関連記事
関連記事「電気陰性度、イオン化エネルギー、電子親和力の違いとは」
続編「電気陰性度で化学結合をスッキリ理解する方法」を読む
お役に立ちましたら、SNSボタンでシェア&Twitterのフォローお願いします。

