
リチウムイオン電池を高校化学で解説
リチウムイオン電池は、高校理論化学(酸化還元反応)で入試頻出のテーマです。
また、日本人が開発に大きく貢献し現在では無くてはならない大変重要な電池です。
(執筆現在2018/10/02:のちに紹介する功績で、水島公一さんと吉野彰さんの2018年のノーベル化学賞受賞が予想されています。発表は2018/10/03(水)18:45からの予定です。)
(追記:2018年のノーベル化学賞は英米の3氏に贈られました)
(追記2:2019/10/09:2019年のノーベル化学賞が本記事でも詳しく触れている吉野彰先生ら3人の研究者に贈られました!)
その仕組みと歴史をこの記事では解説していきます。
(注:あくまで高校化学・難関大入試レベルでの解説の為、理解のしやすさを優先している事をご了承下さい。)
目次(タップした所へ飛びます)
リチウムイオン電池とは
リチウムイオン電池は、その名の通りリチウムを応用し物質を正極・負極に使用した電池です。
リチウムイオン電池は普通の缶電池(アルカリ電池やマンガン電池etc)や、
ダニエル電池・ボルタ電池などの一次電池と違い、二次電池である事が最大の特徴です。
一次電池については→「酸化還元反応の電気分野への応用」と
「ダニエル電池の仕組み」で解説しています。
二次電池と充電・放電
一次電池とは、放電を一回しか行えない電池のことで、
それに対して二次電池は、放電と充電を繰り返して使える「充電池」の事を言います。
スマートフォンやパソコンなどの小型電子機器から、
JAXAが開発し現在小惑星リュウグウに到着した、
はやぶさ2の様な宇宙探査機にまで幅広く使用されています。
初期の二次電池の課題:加熱と起電力
そんな「充電が出来る」二次電池ですが、開発当初は起電力が弱い種類や、
直ぐに加熱して危険であったりと様々な課題がありました。
リチウムイオン電池の実用化
そんな中、2人の日本人「水島公一」氏が1980年に酸化リチウム(1*)を正極として使用する事で、また「吉野彰」氏が1985年に負極にリチウムを含む炭素(2**)を使用する事を考案されたことで、一気にリチウムイオン電池が普及するキッカケになりました。
リチウムイオン電池の仕組み・構造
上記の「リチウムイオン電池の実用化」で書いた仕組みを詳しく説明していきます。
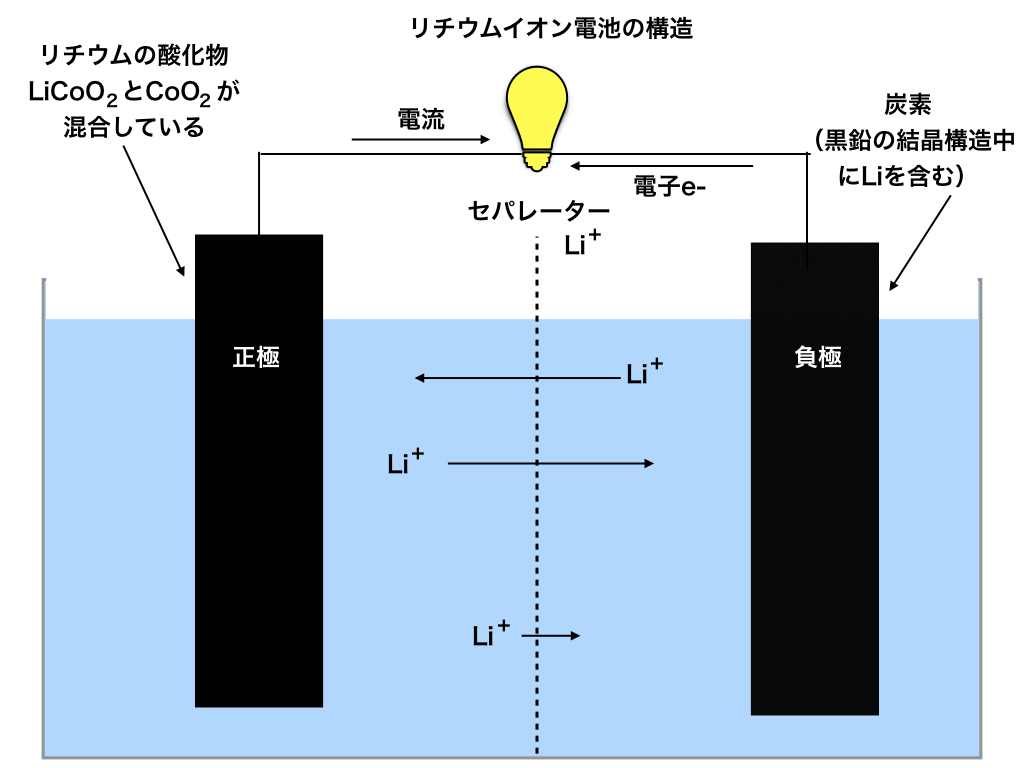
<図1:リチウムイオン電池の仕組み図>
正極の材料:リチウムの酸化物(1*)
水島氏は、リチウムイオン電池の正極に金属のリチウムではなく、$$LiCoO_{2} とCoO_{2}$$を利用する事を考案されます。
金属リチウム単体では反応性が非常に高く、危険性が大きいので取り扱いが難しい面があります。
そこで、コバルトとの酸化物を正極にする事と、後で紹介する電解液の工夫によって、安全性を高められたというわけです。
正極での半反応式
放電時の正極の半反応式は以下の様になります。
充電時はその逆向きの反応が起きます。
$$CoO_{2}+Li^{+}+e^{-}→ LiCoO_{2}$$
もう少し厳密に書くと、正極のLiCoO2とCoO2が
$$混ざった状態をLi_{1-x}CoO_{2},(0≦x<1)$$
$$半反応式は、Li_{1-x}CoO_{2}+xe^{-}+xLi^{+}→ LiCoO_{2}$$
となります。どちらを記述すべきかは問題の指示に従ってください。
負極の材料:黒鉛とリチウム(2**)
負極は先述した通り普通の炭素ではありません。先ほどの電池の図を少し振り返ると↓
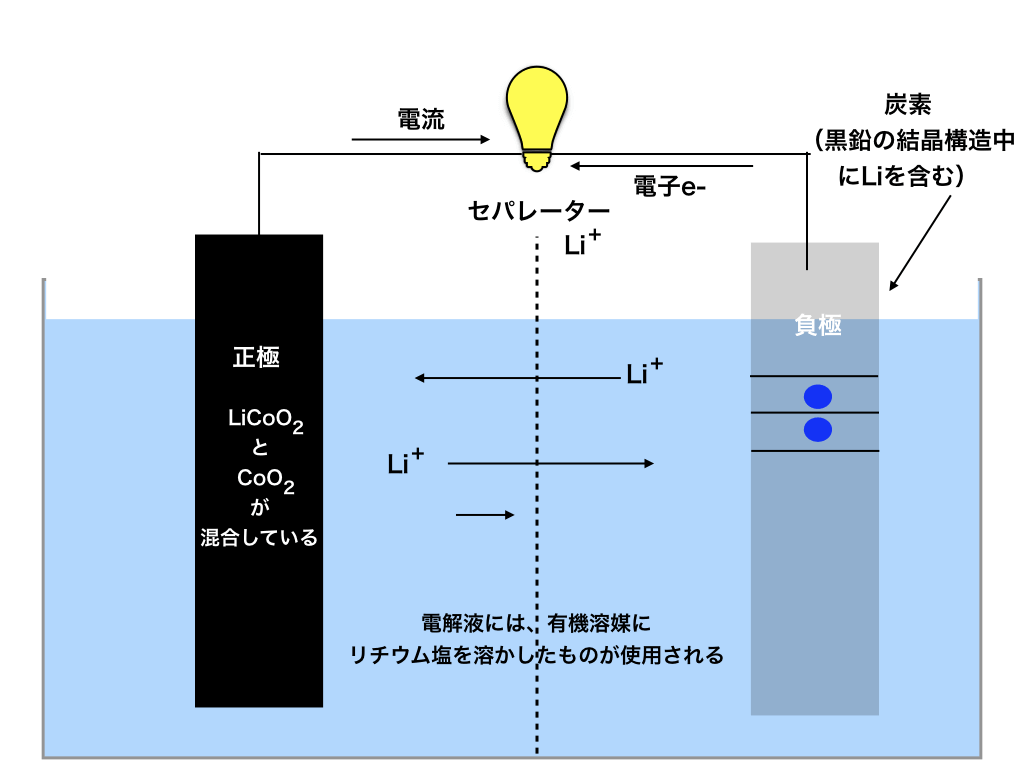
<図2:リチウム電池の負極>
負極に注目してください!この様に炭素の同素体である、黒鉛の層と層の間に青色で描いたリチウムが含まれています。
これが吉野氏の業績です(もちろんこれだけではなく、現在のリチウムイオン電池に使用されている様々な技術を開発されました)。
もう少し負極の材料を詳しく見てみましょう。
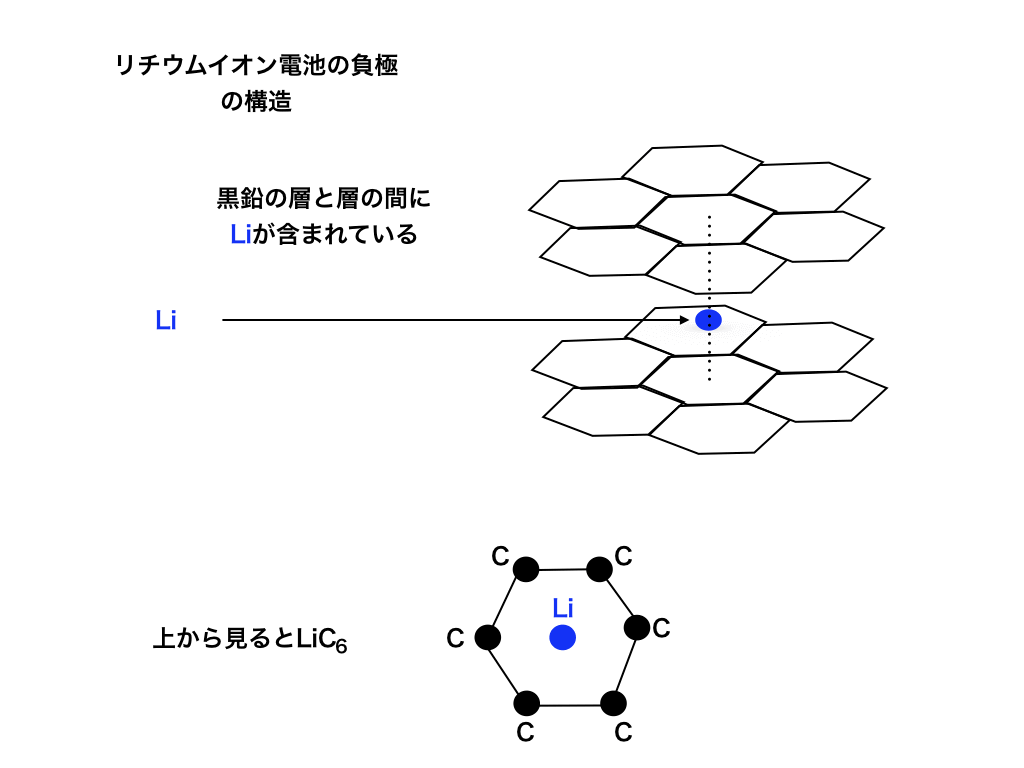
<図3:負極の立体構造(LiC6 )>
黒鉛は<上図3>の様にC原子が蜂の巣の様に結合した層が、ファンデルワールス力(分子間力)によって何層にもわたって重なっています。
その層を上から見ると<上図3下>の様にC6つと、Li1つが対応している様に見える為、負極はLiC6で表されます。
負極での半反応式
電池は、電流の向きと電子が実際に動く向きが逆になっていました。
従って、この負極LiC6から電子が放出されます。
その理由を少し解説すると、リチウムは1族のアルカリ金属なので、希ガス(18族)型の電子配置よりも一個電子が多い不安定な状態です。
つまり、化学的に安定になるために電子を手放したいのです。
そこで以下の半反応式の様に電子を放出します。
$$LiC_{6}→ Li^{+}+e^{-}+C_{6}$$
負極の半反応式も(正極での厳密な半反応式)同様に、
$$Li_{x}C_{6}→ 6C+xe^{-}+xLi^{+}$$
と書きます。このxをつけて解答するかどうかは、先ほどと同じく問題で指示されている方を選んで下さい。
希ガスや電子配置については右の記事で詳しく説明しています→「電気陰性度とは?電子親和力とイオン化エネルギーの違いを徹底解説」
電解液の工夫とセパレータ
電解液には、普通良く使用される水溶液ではなく、有機溶媒にリチウム塩(LiPF6等)を溶かしたものを使用します。
セパレータ(ポリプロピレンやポリエチレンなどの高分子化合物で出来ています)とは、リチウムイオン(Li +)や電解液が通る事ができる程度の非常に小さな穴が空いていて、正極と負極がショートしない様な安全装置の役割を担っています。
電池全体での反応式
以上の正極と負極の半反応式を合わせるとリチウムイオン電池全体としての反応式は
$$LiC_{6}+CoO_{2}→ C_{6}+LiCoO_{2}$$となります。
充電時はこの逆反応が起きます。
酸化還元分野の関連記事
酸化・還元反応の記事をまとめたページを作成しました。
>>「酸化還元反応とは?0から応用まで解説記事まとめ」<<
酸化還元分野の記事まとめ
第1回:「酸塩基反応と酸化還元反応の違いを答えられますか?」
第2回:「イオン化傾向と酸化還元反応(電池)」
第3回:「ダニエル電池の計算問題とファラデー定数」
第4回:「電気分解とは?電池との違いと陽極/陰極でのルール」
第5回:「イオン化傾向とイオン化エネルギーの違いとは?」
第6回:「酸化剤と還元剤を酸化数で見分ける方法」
第7回:「酸化還元反応とアルミニウムの融解塩電解」
第8回:「酸化還元滴定を初めから解説!半反応式の作り方から演習問題まで」
第9回:「今ここです」
今回もご覧いただき有難うございました。
お役に立ちましたら、シェア&当サイト公式Twitter(@linkyjuku_tweet)のフォローをお願いします!
質問・記事について・誤植他はコメント欄、その他のお問い合わせ・ご依頼はお問い合わせページまでお願い致します。

