電気陰性度の意味とその理解に必須の電子親和力、イオン化エネルギーを徹底的に解説します
擬人化してこれらを解説するので、この記事を読み終わる頃には二度と3つの”意味”と”違い”が忘れないようになっているはずです。
ぜひ解説用のイラストを見ながら、記事を読み進めて下さい。
電気陰性度がメインの記事ですが、その前に電子親和力とイオン化エネルギーの解説をします。
$$理由は、電気陰性度=\frac{電子親和力 +イオン化エネルギー}{2}で$$
表される(注1)為、「電子親和力とイオン化エネルギー」を先に理解しなければならないからです。
少し長い記事になりますが、ご了承ください。
目次(タップした所へ飛びます)
電気陰性度のキソ:イオン化エネルギーと電子親和力
これらは全て電子e-の振る舞いが関わっています。大前提として、物質は安定した状態になりたがるという摂理を覚えておいてください。
化学の世界で安定するとは?→希ガス型の電子配置をとること
語弊を恐れず言うと、ズバリ電子の配置が希ガス型になる事です。
ヘリウム・ネオン・アルゴン・・・いずれも電子殻にあるe-が上下左右対称で、安定した状態を保っています。
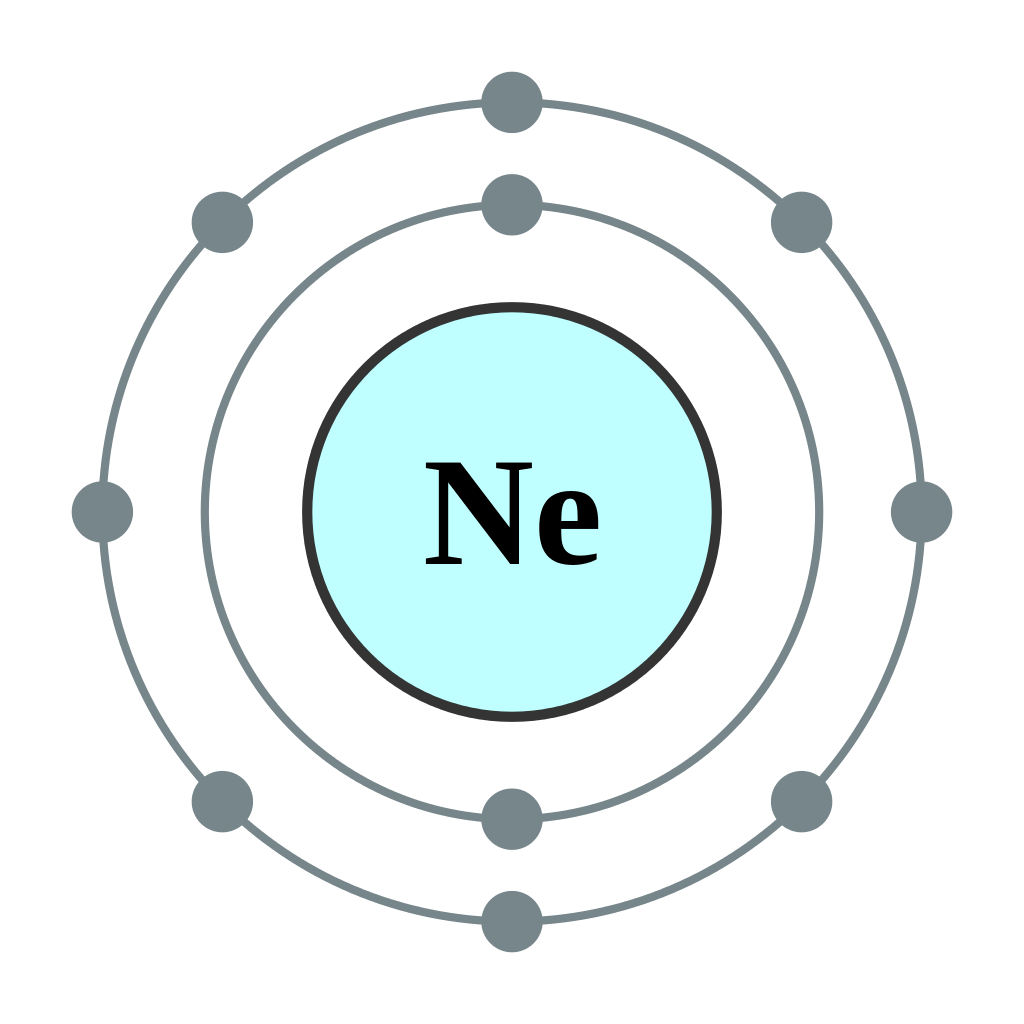
image by Greg Robson
上の図のように、新たに電子が入る電子殻がなく(閉殻)、陽子数と電子数が同じ(Neの陽子の数=プラスの電荷を帯びた個数は10個で、e-も10個)なので電気的にも中性で安定しています。
電子親和力とは?原子達のキモチになってみよう
電子親和力の大小と周期表を重ねると、以下のようなイメージになります。
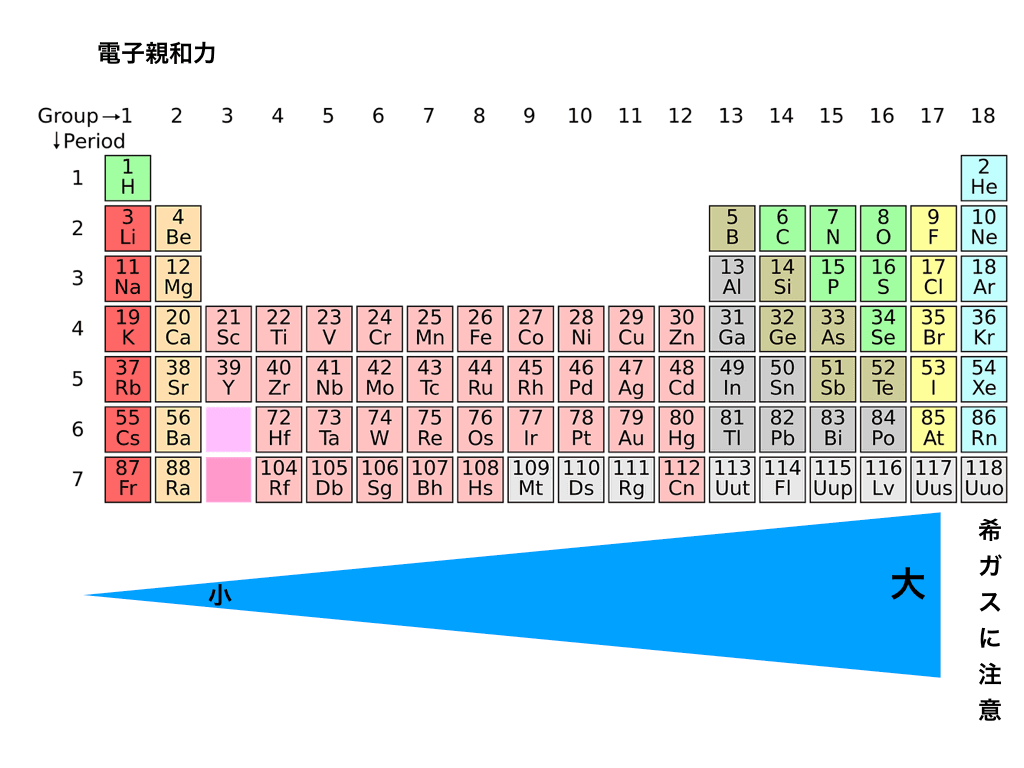
<図1:電子親和力の大きさと周期表>
例えば、F:フッ素は電子が1つ足りないばっかりに「Ne:ネオン型」になれません。
もしあなたがフッ素なら(擬人化して考えることは、特に理系科目にとって理解への最短ルートです)なんとしてでもあと一つ電子が欲しいはずです。
この「電子を欲しいキモチ」が電子親和力です。
読んで字の如く電子と親しくなりたいのです。
従って希ガス(18族)に近づくほどこのキモチ=力は強くなります。
しかし“希ガスそのもの”は既に安定しているので、電子など欲しくありません
(故に数値は非常に小さいです)よってハロゲン(17族)が最大となるのです。
第1イオン化エネルギーとは
次は、(第一)イオン化エネルギーと周期表を合わせた図です。
電子親和力の時と少し違う点として、
・周期表の上に行くほど(すなわち周期番号が小さいほど)値が大きくなること、
・電子親和力では希ガスの値は定義されていませんでしたが、イオン化エネルギーでは定義されており、同じ周期ならば18族=希ガスが最大になる点に注意してください。
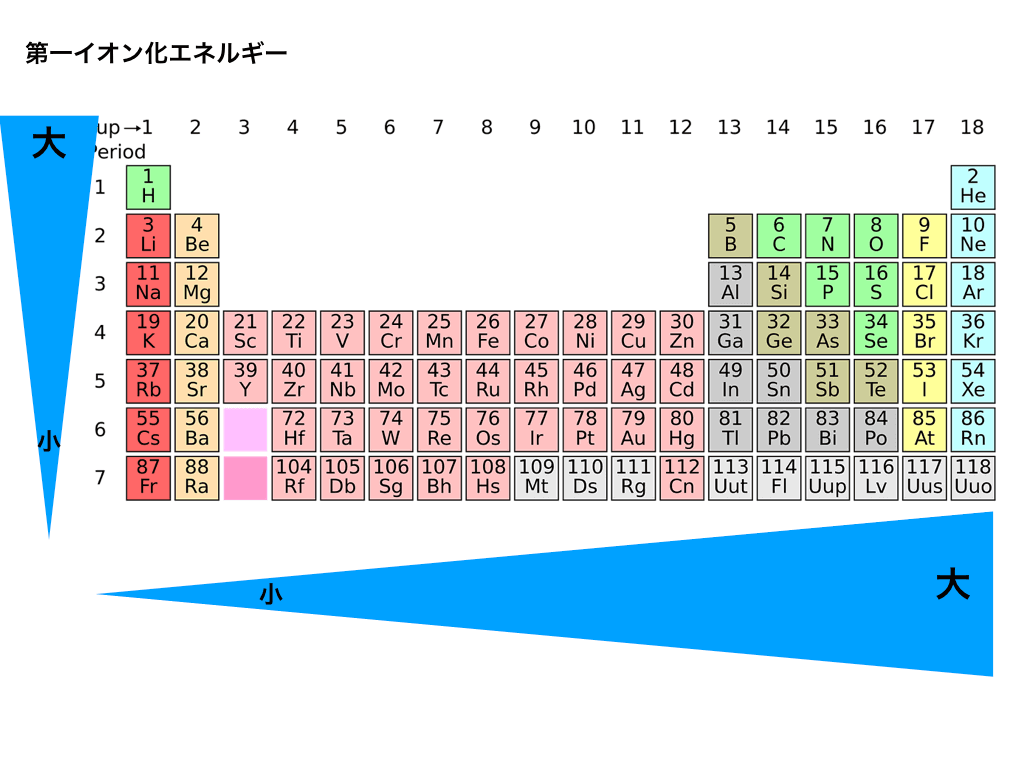
<図2:第1イオン化エネルギーと周期表>
では、ふたたび擬人化して第一イオン化エネルギーの意味を考えてみましょう。
これは「電子を手放してもいいかなぁ」と原子が思うエネルギーの量と考えてください。
フッ素君は、あと電子一個受け取れば憧れのネオン型になれるのに、
そのフッ素君から電子を奪うには相当大きなエネルギーが必要です。
さらに希ガス君に至ってはもっと電子を手放したくないでしょう。だって既に安定した地位にいるのです。
従ってイオン化エネルギーは希ガスが最大となります。
周期が上になる程イオン化エネルギーが大きくなる訳
先ほど載せた<図2>と、その少し上でか紹介した通り、第一イオン化エネルギーは、周期の番号が小さくなる(同じ族なら、原子番号が小さくなる)程、その値は大きくなっています。
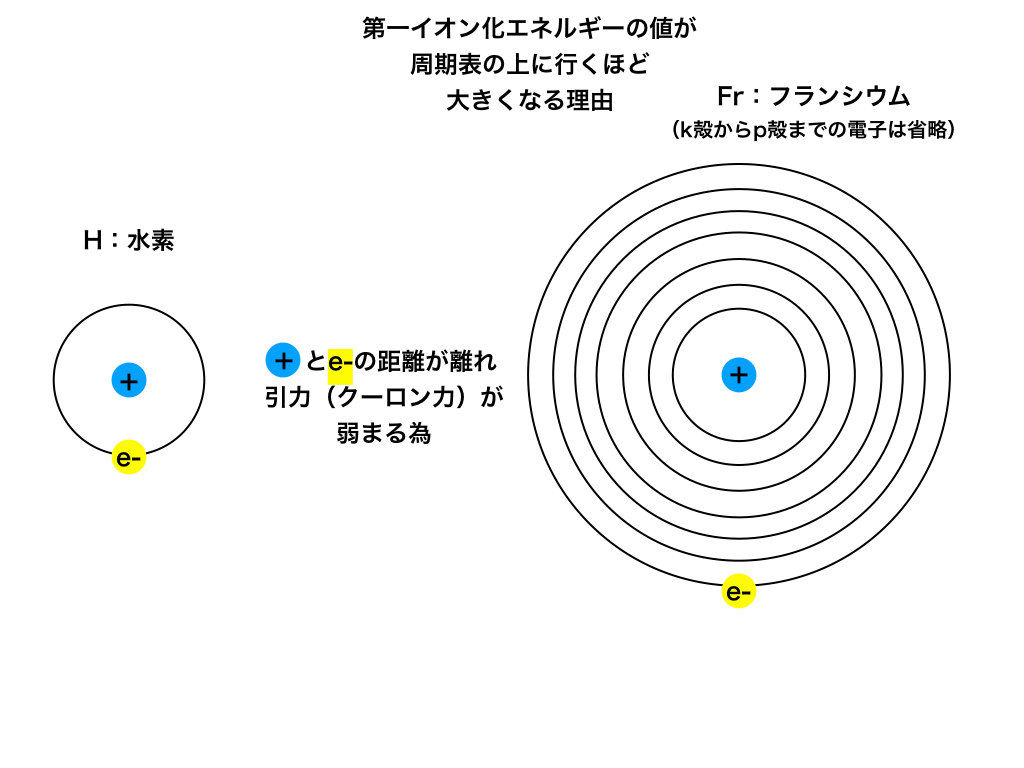
<図3:イオン化エネルギーと電子および原子核との距離>
その理由は、上の<図3>の様に「最外殻電子」と「原子核中の陽子」の距離が関係しています。
同じ1族の”水素”と”フランシウム”を見てみると、最外殻電子(ここでは手放す電子)と陽子の距離が、
水素<<<フランシウムになっています。
電子(ーの電荷)と陽子( +の電荷)の距離が近いほど引き合う力(クーロン力)は大きくなり、それだけ手放させるために必要なエネルギー(=イオン化エネルギー)が大きくなります。
物理でこのクーロン力を習いますが、未習の人や復習したい方は>>(参考:「クーロン力の公式と電位・電場の違いをイメージする」)<<の記事前半で詳しく解説しています。
この様な理由で、周期表の上に行く程イオン化エネルギーの値は大きくなります。
更に、上で説明した通り右へ行くほど値が大きくなるので、
結果として周期表の右上の第一イオン化エネルギーが最大になるのです。
イオン化エネルギーとイオン化傾向の違い(参考)
イオン化エネルギーとイオン化傾向は何が違うの?
という質問が非常に多いので、別記事で詳しく解説しました!
電気陰性度とは?
お待たせしました。やっと本題の電気陰性度です。電子親和力とイオン化エネルギーの知識を持っておけば全く『恐るるに足らず』です。
また、この電気陰性度の理解度が高校化学(理論・無機・有機)の全分野で最も重要であることが徐々にわかってもらえるはずです。
電気陰性度の定義
電気陰性度とは、原子が電子を出し合い、2原子以上の分子になったとき<共有結合と言います>原子間にある【電子対を引っ張る力の強さ】のことを言います。
具体的にこれまでの知識を使って電気陰性度を表すと、(*1)(電子親和力+イオン化エネルギー)÷2
つまり、族番号が大きくなるにつれて、又、同じ族なら周期の番号が小さくなるに連れて電気陰性度も大きくなります。
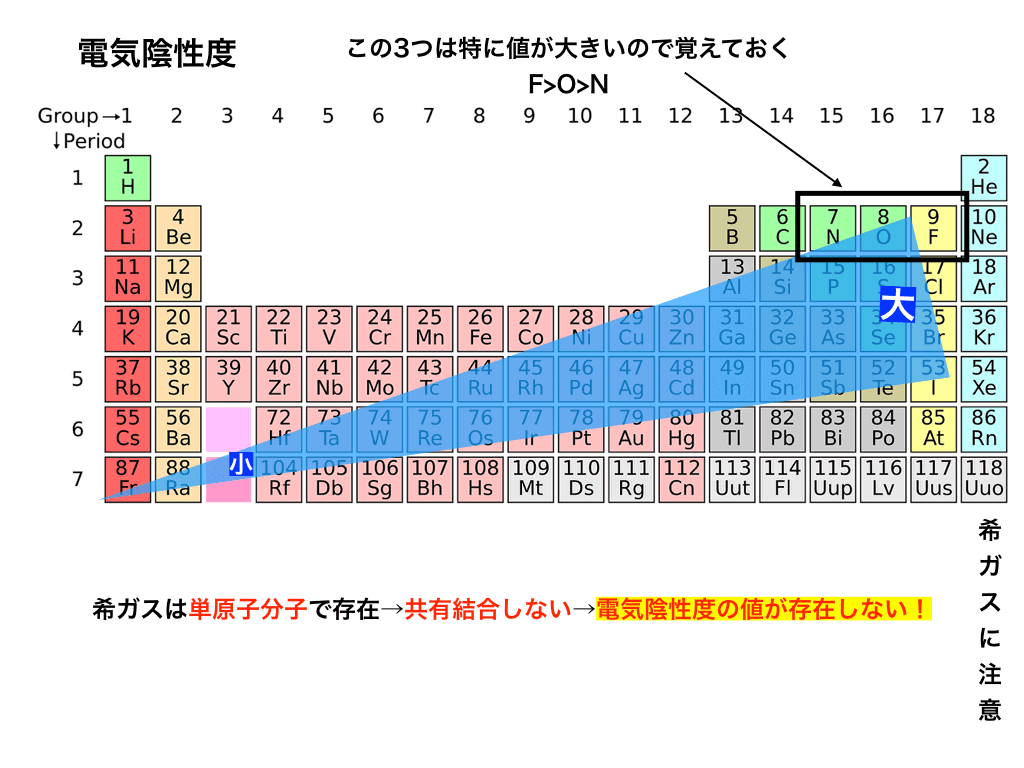
電気陰性度と周期表
電気陰性度の大小を周期表で見てみましょう。
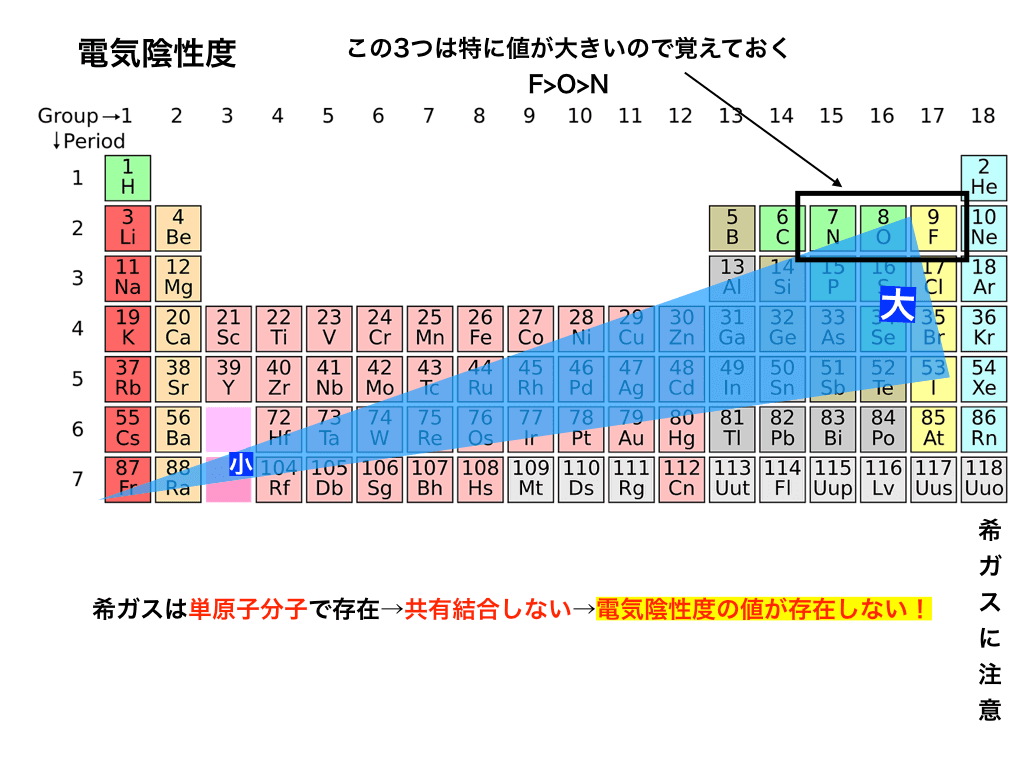
特に、電気陰性度が大きい右上の3つの元素:「Fフッ素、O:酸素、N:窒素」は、のちに説明する極性や水素結合で重要になるので覚えておきましょう。>>「電気陰性度と電子式で極性の有無と分子の形を予測する方法」<<で、極性と分子の形について詳しく解説しています。
希ガスの値が無い理由
希ガスは共有結合しない(単原子分子になってしまう)ので、そもそも電子対を引っ張る力を意味する電気陰性度が存在しません。
また、先ほどの定義式で必要な「電子親和力の値」が希ガス(18族)では定義されていませんでした(忘れた人は、上の電子親和力の項まで戻って確認してください!)
このようなわけで、希ガスには電気陰性度の値が与えられていないのです。
(*注1:厳密には上記の電気陰性度の定義式は、ロバート・マリケンという人のもので現代における定義とは少し異なっています。しかし、まずは大まかな考え方として理解してください)
いかがでしょうか。やっとザックリとした電気陰性度の説明までたどり着きました。
次の投稿ではこれを活用して化学結合の真実を紹介していくことにします。
最後に:電気陰性度の重要性と関連記事まとめ
以下の関連記事を読み進めると、化学基礎であいまいにされている”電気陰性度”の解説を通して、分子の形や化学結合の正体など、暗記するしかないと思われている事にも実はイミがあり、つながりがあることに気づく事が出来ます。
【電気陰性度を制する者は高校化学を制する】と言い切れる程に最重要なのですが、どうもあいまいな生徒が非常に多いです。化学は一旦理解できると非常に安定して得点できるので、短期間で完成させると、他科目に時間を回すことができます。
ぜひこのサイトを徹底的に利用して効率よく合格を勝ち取ってください!
電気陰性度を応用して化学結合や極性まで理解しよう(続編)
化学結合の正体:「共有結合と金属結合、イオン結合は同じだった!?」を読む。
(電気陰性度を使って、3つの化学結合の正体を明らかにしています。)
電気陰性度と極性、分子の構造の記事を作成しました。下のリンクよりご覧下さい。
→「電気陰性度と電子式で極性と分子の形を予測する方法を限定解説!」を読む。
今日紹介した内容は基礎的ですがいくら強調してもしすぎることがない重要な事柄です。
是非何度も読んで自分のものにしておいてください。
質問・記事について・誤植・その他のお問い合わせはコメント欄までお願い致します。
今回も最後までご覧いただき有難うございました。

