
「イオン化エネルギー」と「イオン化傾向」の違いとは
この記事では、似ていて違いがわかりにくい
「イオン化傾向」と「イオン化エネルギー」について、
それぞれの意味と、順序が少し異なっている理由を詳しく解説しています。
目次(タップした所へ飛びます)
イオン化傾向とイオン化エネルギーの違い
どちらも「イオン化」のしやすさを表すものですが、どこが違うのでしょう?
今回はそれぞれについて詳しく学んでみます。
(前回までの「イオン化傾向と酸化還元シリーズ」は、記事の最後にまとめています。)
「イオン化エネルギー」とは
「イオン化エネルギー」とは、単体の原子から電子を奪って陽イオンにするために必要なエネルギーの事でした。
(参考):「電気陰性度、電子親和力とイオン化エネルギーの違いを答えられますか?」
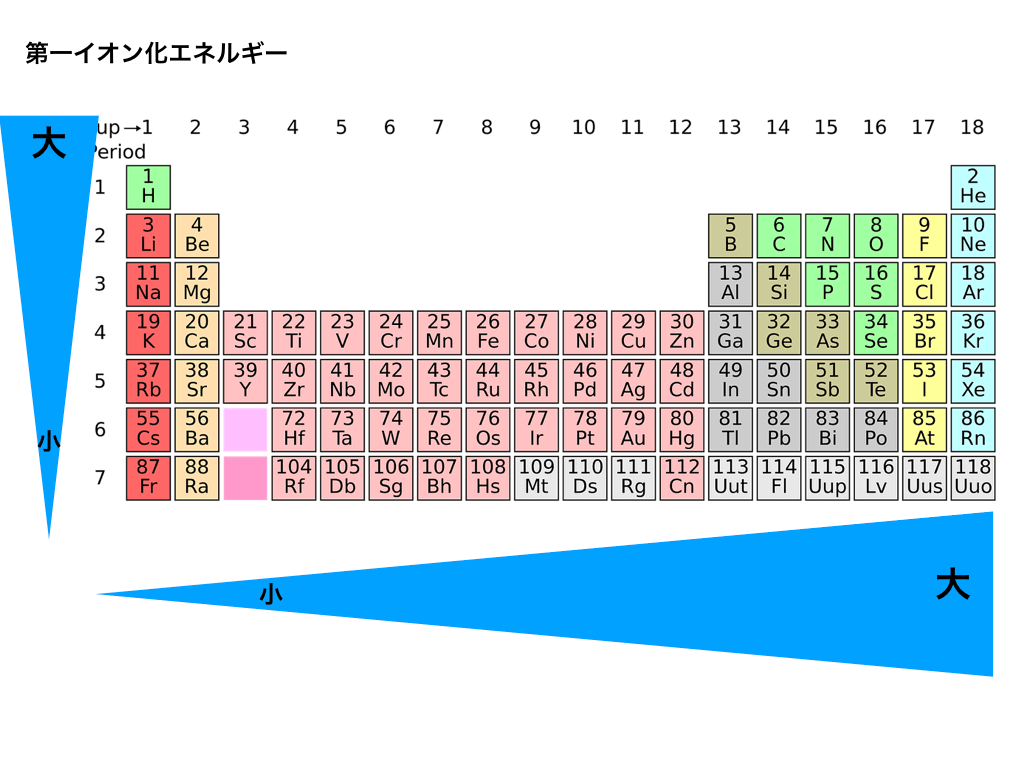
従って、希ガスのような安定した原子は極端に大きな値を取ります。
そして、ハロゲンなどの最外殻電子があと一つで希ガス型の電子配置になることが出来る原子のイオン化エネルギーも大変大きいものになります。
一方で、アルカリ金属やアルカリ土類金属などの、希ガス型の電子配置よりも電子が少し余っているものは、電子を減らしたいので、少ないエネルギーで電子を放出する(=イオン化エネルギーが小さい)のでした。
つまり、イオン化エネルギーとは原子が所有している電子の取り出しにくさを表す指標であるということができます。
そして、イオン化エネルギーが小さければ小さいほど、陽イオンになりやすく
、反対にイオン化エネルギーが大きければ大きいほど陽イオンになりにくいのです。
ここで、イオン化エネルギーとよく引き合いに出される「電子親和力」についても軽く確認しておきましょう。
「電子親和力」とは、”単体の原子に電子を一つ加えて陰イオンにするときに放出されるエネルギー”
のことを指します。電子親和力はハロゲンにおいて最大になります。
イオン化エネルギーと電子親和力の二つは混同する受験生が多いため、センター試験でもその違いを問う問題は頻出です。
具体的には、電子を「取り去る」のか「外部から加える」のか、
そしてエネルギーを「必要とする」のか「放出する」のか、
の2ポイントについて問われる場合がほとんどです。しっかりと覚えておきましょう。
詳しくは→<参考:「イオン化エネルギー・電子親和力・電気陰性度の違いを解説」>
第nイオン化エネルギー
さて、再びイオン化エネルギーを見ていきます。
少しハイレベルですが、イオン化エネルギーというのは第1イオン化エネルギー、第2イオン化エネルギー……というように分類されます。
最も試験で問われることが多いのは第1イオン化エネルギーです。
第1イオン化エネルギーとは、上で書いた通り、単体の原子から電子を一つ奪って陽イオンにするのに必要なエネルギーのことを指します。
次に、第2イオン化エネルギーはそこから『さらにもう一つ電子を奪うのに必要なエネルギーのこと』を指します。第3イオン化エネルギー以降についても同様です。
一般的には、第1イオン化エネルギー<第2イオン化エネルギー<第3イオン化エネルギー......。という順に大きくなっていきます。
これは陽イオンの価数が増えることによって
(電子を取り出すことでe-が減る一方で、原子核中の陽子の数は変化しません)、
イオンの『正電荷と、次に取り去ろうとする電子の間のクーロン力に拮抗する力』を新たに加える必要が出てきてしまうことに起因します。
難関大を目指すという人は、イオン化エネルギーと電子親和力について、このように原子物理の分野とリンクさせつつ学習することで、
暗記量を減らすとともに、2次試験における対応力をグンとアップさせることができます。
(参考2)「高校物理と化学がつながる!水素原子のエネルギー準位とイオン化エネルギー」
イオン化傾向とは
一方で、イオン化傾向はどの様なものだったかと言うと、
固体の金属原子が水溶液に溶けて陽イオンになる“なりやすさ”を順番に並べたものでした。
イオン化する「過程」の違い
上のイオン化エネルギーとイオン化傾向の復習を読みながら見てほしいのですが、
イオン化エネルギーでは「単体の金属」から電子を奪って陽イオンにする為のエネルギーと書きました。
一方で、イオン化傾向では、「固体の金属」が水溶液へ溶けて陽イオンになる「傾向(=なりやすさ)」を表しています。
金属は普通固体で、金属結合によって結びついています。
これを「単体」にするためには、気体の状態にしなければいけません。
すなわち、「イオン化傾向」と「イオン化エネルギー」では以下のように経る過程が違ってくるのです。
イオン化の順序と昇華熱・水和熱
イオン化傾向:金属(固体)→(昇華)→金属(単体:気体)→(電子を奪う)→陽イオン→(水溶液に溶かす)→水和イオン
イオン化エネルギー:金属(単体:気体)→(電子を奪う)→陽イオン
上の二つは、太字で強調した部分は共通していますが、
イオン化傾向の方が「昇華」させて、「水和」させるので反応は複雑になります。
もう1ランク上へ:違いをエネルギー図で理解する
ここまでで、「昇華」・「水和」時に必要な熱量とその過程が、「イオン化傾向」と「イオン化エネルギー」の大きな違いであることを紹介しました。
さらに理解を深めるために、過程の違いとともにエネルギー図を書いて、それぞれの熱やエネルギーを視覚的に把握することが重要になってきます。
熱化学の分野に入るので、詳しくは右の記事をご覧ください。→(「熱化学:6種類の熱と3種類のエネルギーをエネルギー図を書いて徹底理解!」)
イオン化しやすさが異なる実例
ここでは、イオン化傾向とイオン化エネルギーの順序が違う例を紹介します。
イオン化傾向では、イオン化しやすい順に、
Li>K>Ca>Na>Mg>Al>Zn>Fe>Ni>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au となります。
基本的には「イオン化エネルギーを小さい順に並べたもの」と、「イオン化傾向」を並べるとほぼ同じ順番になるのですが、上述した通り“昇華熱や水和熱の影響”で順序が変わる事があります。
その有名な例として『アルカリ金属元素』を見て見たいと思います。
イオン化傾向では、Li>K>Na
イオン化エネルギーは、Li>Na>Kの順になっています。
このような例も覚えておくと、ライバルに一歩差をつける事ができるとともに、色々な分野の復習にもなるので常に「ギモン」を持つ事が大切です。
まとめと酸化還元反応シリーズ
・イオン化傾向とイオン化エネルギーの違いは、出発点と到着点の違い(イオン化する過程の違い)
・(出発点の違い):イオン化傾向が固体から「昇華」して気体の金属になるのに対して、イオン化エネルギーは初めから気体の金属である。
→昇華熱の分だけ差が出る
・(到着点の違い):イオン化傾向が水和イオンになるまでをもとにしているのに対して、イオン化エネルギーは陽イオンになった時までのエネルギーを計算している。
→水和熱の分だけ差が出る
したがって、
・昇華熱と水和熱によって、順序が微妙に変わる。
このように”イオン化傾向”と”イオン化エネルギー”という2つの言葉は名前こそ似ているものの、本来は違う分野に由来するものです。
しかし、両者とも熱化学の問題で取り上げられることが多いので、出発点と到着点の違いを把握し、納得のいくまでエネルギー図を書くこと大切です。(再掲)<「6種類の熱+3種類のエネルギーの出発点と到着点をエネルギー図で理解する」>
イオン化傾向と酸化還元反応(電気化学)シリーズ
酸化還元反応シリーズ
第4回:「電気分解とは?電池との違いと陽極/陰極でのルール」
第5回:「イオン化傾向とイオン化エネルギーの違いとは?」<今ココです>
第6回:「酸化剤と還元剤を反応式から見分ける酸化数の徹底解説」
「酸化還元反応の単元総まとめページ」を作成しました!

