
アルミニウムの製法と性質(高校無機化学)
我々にとって最も身近な金属の1つであり、無機化学だけでなく、理論(酸化還元)分野と融合して出題される、アルミニウム:Al。
今回はそのアルミニウムの製法について学びます。この記事を読むと、
・アルミニウムが「電気の缶詰」と呼ばれる訳
・アルミニウムの性質&関連する金属
・融解塩電解の手順と特徴
・酸化還元反応の計算問題と解き方
が分かります!
酸化還元反応について、詳しくは→<酸化還元分野をはじめから!0からの解説記事まとめ>←のページに記事をまとめています。
ではさっそく見ていきましょう。
目次(タップした所へ飛びます)
アルミニウムの製法~何故電気の缶詰と呼ばれるのか~
アルミニウムは「電気の缶詰」とよく言われます。
これは、鉱石(ボーキサイト)の状態から、後述する融解塩電解をへて、我々が知っているアルミの状態になるまでに莫大な電力を必要とするからです。
では、ボーキサイトからアルミニウムになるまでの流れを見て行きましょう。
ボーキサイト:アルミニウムのもと
アルミニウムのもとはボーキサイトと呼ばれる鉱石です。様々な化合物(酸化鉄や二酸化ケイ素など)が混ざっています。
その内の\(\mathrm{Al_{2}O_{3}}\)が主成分です。
化学式を見るとわかるように酸化物なので、これを還元して単体のアルミニウムにする必要があります。
アルミナ:ボーキサイトから取り出した酸化アルミニウム
"ボーキサイト"にNaOH(濃水酸化ナトリウム水溶液)を作用させて処理すると、
\(\mathrm{Al_{2}O_{3}}\)を得る事ができ(バイヤー法)これを「アルミナ」と言います。
たまにこのアルミナに少し不純物が混じったものが天然で産出されることがあり、それらは宝石の「ルビー」・「サファイア」として知られています。
融解塩電解と氷晶石(ホール・エルー法)
さて、ここからが入試・模試で問われる内容に入ります。
ホール・エルー法と呼ばれる電気分解の一種によって、アルミナ中の酸素が還元されて単体のアルミニウムが生成されます。
>「電気分解の仕組みと陽極・陰極でのルール」<電気分解の復習はこのページをご覧ください。
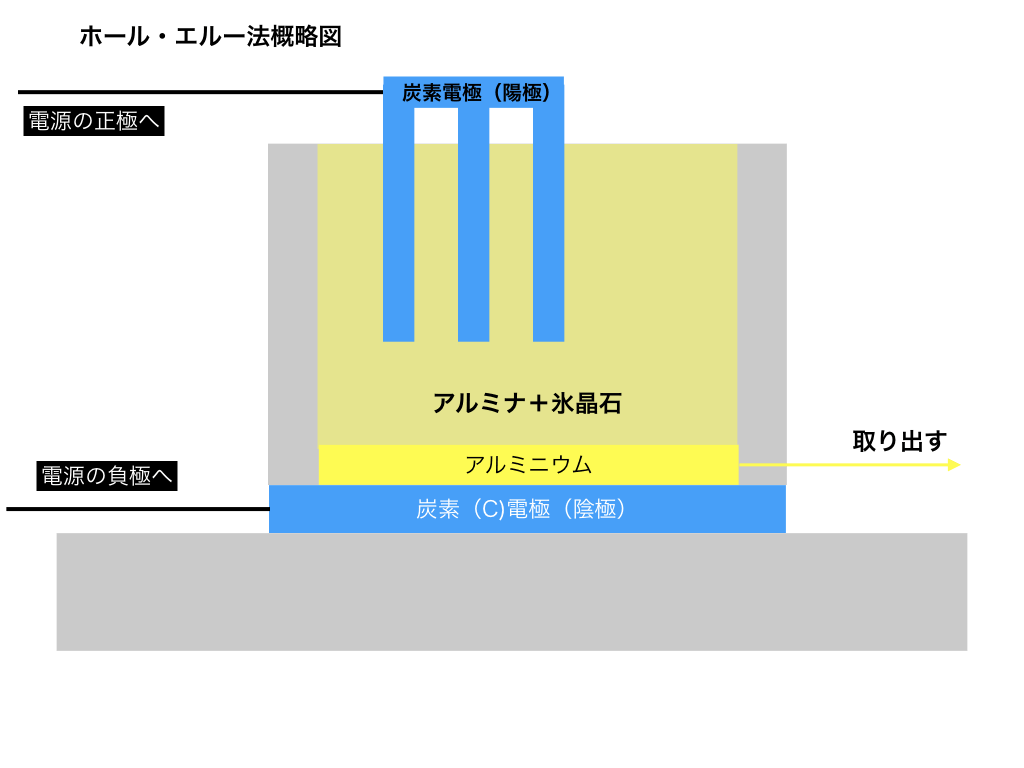
<ホール・エルー法概略図:図1>
このホール・エルー法は、酸化アルミニウム(アルミナ)を高温で融かして液体にしたものを電気分解する「融解塩電解」という方法をとります。
この「高温で融かす」際に莫大な電力が必要とされるのです。
(よって、アルミニウムの精錬は電気が比較的安価で使用できる水力発電が活発な国・地域で行われる事が多いです)
ホール・エルー法の反応式
ホール・エルー法では炭素を極板として<図1>の様な工場でアルミニウムを精錬します。
\(\mathrm{Al_{2}O_{3}+ 3C }\rightarrow 2\mathrm{Al+3CO}\)
なぜ銅のように電気分解できないのか?
イオン化傾向を思い出す<参照「イオン化傾向とは?」>と、
K,Ca,Na,Mg,Al,Zn,Fe,Ni,Sn,Pb(H),Cu,Hg,Ag,Pt,Au の順にイオンになり易さ大>>小と並んでいます。
AlはCuに比べてはるかにイオン化傾向が大きく、銅のように簡単に析出してくれなません。
電気分解を水溶液中で行っても水が先に電子を奪ってしまう(還元される)のです。
そこで、無理やりアルミナを融かし、イオン化する方法をとるしかないのです。
氷晶石の役割
アルミナ(酸化アルミニウム)は融点が非常に高いため(2000℃以上)、
ホール・エルー法では、少しでも電気を節約するために”融点を下げる材料”として”氷晶石”\(\mathrm{Na_{3}AlF_{6}}\)を混ぜる事で融点を約960℃まで下げています。
アルミニウムの性質と合金
アルミニウムの製法の次はその性質や応用を見ていきます。
軽金属・不動態・両性金属etc・・・
軽金属:密度が小さい
アルミニウムは密度が金属の中でも小さく、「軽金属」と呼ばれます。他の軽金属は、Mg(マグネシウム)やチタン、アルカリ金属/アルカリ土類金属などがあります。
反対に密度の大きい金属は「重金属」と言います。(重金属は銅や鉛・亜鉛・金などのアルカリ/土類金属以外のほとんどの金属)
両性金属:酸・塩基両方と反応する
アルミニウムと亜鉛、スズ、鉛(Al、Zn、Sn、Pb)は、酸とも塩基とも反応してとけるため「両性金属」と言います。
強酸との反応式の例
\(2\mathrm{Al+6HCl}\rightarrow 2\mathrm{AlCl_{3}+3H_{2}}\)
強塩基との反応例
\(2\mathrm{Al+2NaOH} \rightarrow 2H_{2}+ 2\mathrm{Na}[\mathrm{Al(OH)}_{4}]\)
強塩基との反応については、「錯イオンとは」(現在作成中です)でまとめて解説していきます。
不動態
Alは、Fe(鉄)Ni(ニッケル)とともに、空気中ですぐさま酸化されて「緻密な酸化被膜」を作る事で腐食されにくくなる性質を持っています。これを不動態と言います。
入試では「緻密な酸化被膜(ちみつなさんかひまく)」をよく記述させる問題が出るので覚えておきましょう。
アルマイト加工:意味とメッキとの違い
不動態の性質を活かして、腐食しやすい金属に酸化アルミニウムを人工的に表面を覆う事があります。
これを「アルマイト加工」や、「アルマイト処理」などと言います。
(メッキは、電気分解の陰極で行いますが、アルマイト加工は陽極で行う点で違います)
アルミニウムの合金
「ジュラルミン」の言う合金が最も有名です。アルミニウムの軽さと、等の強さを併せ持つので、ジュラルミンケースや飛行機の胴体に使われます。
クラーク数
クラーク数とは、地殻中にある元素をその割合が大きい順に並べたものです。
入試においては以下の6番目までは覚えておきましょう。
\(\mathrm{O>Si>Al>Fe>Ca>Na}\)
最後にホール・エルー法の復習を兼ねた計算問題を解いてみましょう。
確認例題:ホール・エルー法とファラデー定数
酸化アルミニウム\(\mathrm{Al_{2}O_{3}}\),アルミナ)から、ホール・エルー法でアルミニウムを取り出した。
2(kA)の電流を2時間30分間流した時に陰極にたまるアルミニウムの質量を求めよ。
ただしファラデー定数F=96500(C/mol),Al=27(g/mol)とし、有効数字二桁で答えよ。
解答解説
融解されたアルミニウムは、イオン化し3価の陽イオンとなります。
これに電子\(e^{-}\)が1:3の比率で反応するので
・まず与えられた$$\frac{電流\times 時間}{ファラデー定数} $$で電子のmol数を計算し、
・次に\(\mathrm{Al^{3+}+3e^{-}} \rightarrow \mathrm{Al}\) より
\(\frac{1}{3}\)の物質量のアルミニウムが取り出せるので、
・その物質量\(× 27(g/mol) \)で、精錬されたアルミニウムの質量が計算できます。
ゆえに、2キロアンペアは2000(A)、
2時間30分は\(60× 60× 2 +30× 60)=9000(s)\)
$$⇔ \frac{2000× 9000}{96500}$$ (mol)の電子が流れるので、
$$⇔ \frac{2000× 9000}{96500}× \frac{1}{3}\times 27 $$
これを計算して1000で割ると、≒1.67Kgとなり、有効数字二桁で1.7(Kg) が答えです。
まとめと関連記事
・アルミニウムは無機化学(特に金属)分野では、鉄や銅と並んで頻出の元素です。
・この記事である程度情報をインプットしたら、問題集を解いてみて下さい。
・足りない知識があればノートなどにまとめて、この記事と共に定期的に見直していきましょう。
(NEW!!)「無機化学:工業的製法の記事まとめページ」
「無機化学と関係が深い酸化還元の記事」
第1回:「酸塩基反応と酸化還元反応の違いを答えられますか?」
第2回:「イオン化傾向と酸化還元反応(電池)」
第3回:「ダニエル電池の計算問題とファラデー定数」
第4回:「電気分解とは?電池との違いと陽極/陰極でのルール」
第5回:「イオン化傾向とイオン化エネルギーの違いとは?」
第6回:「酸化剤と還元剤を酸化数で見分ける方法」
第7回:「今ここ」
第8回:「酸化還元滴定を初めから!半反応式の作り方から演習問題まで」
>>【酸化還元反応とその周辺の解説記事まとめ(NEW)!】<<
今回も最後までご覧いただき有難うございました。お役に立ちましたら、シェア&当サイト公式Twitterのフォローをお願いします!
質問・記事について・誤植ほかはコメント欄、その他のお問い合わせ・ご依頼はお問い合わせページまでお願い致します。

