酸化還元滴定(1)
酸化還元滴定は酸/塩基の中和反応よりも複雑だと思っていませんか?
この記事では、
・酸塩基反応との違い
・酸化還元滴定に必須の「半反応式」の記憶量を激減させる方法
・酸化還元滴定の手順
・実際に上で学んだ事を定着させる問題
をそれぞれ解説していきます。
2019/04/22更新:酸化還元反応を0から学べるまとめページ「酸化還元反応の基礎から応用まで総まとめ」を作成しました。
更に次回は、今回の内容をもとに
確実に差を付けるために必須のCOD(化学的酸素要求量)やBOD、ヨージメトリー/ヨードメトリーをスラスラと解ける方法を紹介していきます。
文中に関連記事を載せているので、酸化還元反応の初心者でも是非読んでみてください!
目次(タップした所へ飛びます)
酸化還元滴定とは
酸化還元反応を利用して、濃度未知の酸化剤/還元剤に、濃度が分かっている還元剤/酸化剤を滴定する事によって、未知の濃度を求める事を言います。
酸塩基の中和滴定とイメージは似ていますが、いくつか相違点があります。
酸塩基の中和滴定との違い
酸塩基の中和滴定とは何が違うのでしょうか?
酸塩基反応と酸化還元について詳しくは
>>「酸塩基反応と酸化還元反応の違いを答えられますか?」<<
で解説していますが、ポイントは
・酸・塩基はプロトン\(H^{+}\)の受け渡し
・酸化・還元は電子\(e^{-}\)の受け渡し
であることが最大の違いです。
酸化還元滴定と指示薬
高校レベルの酸化還元滴定では、酸塩基の中和滴定と違い指示薬を使いません。
実際には、酸化還元指示薬自体は存在するのですが、高校化学の範囲内では使いこなせない為です。
代わりに、酸化剤or還元剤そのものの色が変化する事で、過不足なく反応が終了した点(これを当量点と言います)が分かる酸化・還元剤のみ出題されます。
酸化剤と還元剤の半反応式の作り方
酸化還元滴定では、酸化剤・還元剤の電子のやり取りを使って問題を解いていきます。
その際に酸化剤・還元剤の半反応式を書けることは必須です。
参考:「酸化剤と還元剤を酸化数で見分ける方法」
半反応式の【一部】だけ覚える
しかし、半反応式の全てを覚える必要はありません!
記憶するのは、酸化剤/還元剤の変化だけ!
例えば、教科書に過マンガン酸カリウム(酸化剤)の半反応式が載っていると思います。
\((MnO_{4})^{-}+8H^{+}+5e^{-} →Mn^{2+}+4H_{2}O\)
これが十数個あるので、半反応式を全て覚えることは労力がかかるだけでなく、ミスの可能性も増えて何もいい事が有りません。
そこで、見出しにも書いたように覚えることは「酸化剤/還元剤」が変化する所だけ(過マンガン酸カリウムなら\((MnO_{4})^{-}→Mn^{2+}\)だけにします。
酸化剤で覚えること
\((MnO_{4})^{-}\rightarrow Mn^{2+}【酸性条件】\)
\((MnO_4)^{-}\rightarrow MnO_{2}【中性条件】\)
\(オゾン:O_{3}\rightarrow O_{2}\)
\(二クロム酸カリウム(Cr_{2}O_{7})^{2-}\rightarrow 2Cr^{3+}\)
\(X_{2}\rightarrow 2X^{-}\)【Xはハロゲンを意味します】
\(H_{2}SO_{4}\rightarrow SO_{4}\)【熱濃硫酸の時】
\(HNO_{3}\rightarrow NO_{2}\)【濃硝酸】
\(過酸化水素:H_{2}O_{2}\rightarrow 2H_{2}O\)
還元剤で覚えること
\(H_{2}C_{2}O_{4}\rightarrow CO_{2}【シュウ酸】\)
\(M\rightarrow M^{n+}【Mは金属】\)
\(二酸化硫黄:SO_{2}\rightarrow SO_{4}^{2-}\)
\(硫化水素:H_{2}S\rightarrow S\)
\(ヨウ化物イオン:2I^{-}\rightarrow I_{2}\)
\((2S_{2}O_{3})^{2-}\rightarrow (S_{4}O_{6})^{2-}\)
\(鉄(2)イオン:Fe^{2+}\rightarrow Fe^{3+}\)
\(H_{2}O_{2}\rightarrow O_{2}\)
半反応式はその場で作る
上記の酸化剤/還元剤の変化を覚えることが出来れば、半反応式は以下の手順で作ることができます。
例として「過マンガン酸カリウム(酸性条件下)」の半反応式を作ります。
半反応式作成手順その一:一部を書く
覚えた酸化剤/還元剤の部分を書く
\((MnO_{4})^{-}\rightarrow Mn^{2+}\)
その二:水で調整
左右の式で酸素Oの数が同じになる様に、水\(H_{2}O\)で調整する。
ここでは、反応物にOが4つあり、生成物にはOがありませんから、
生成物側に\(H_{2}O\)を4つ加えることでOの数が等しくなります。
\((MnO_{4})^{-}\rightarrow Mn^{2+}+4H_{2}O\)
その三:水素イオン(プロトン)で調整
今度は、水素Hの数が同じになる様に\(H^{+}\)で調整する
次は【その2】で4つ\(H_{2}O\)を加えた為に水素Hの数が反応物側0、生成物側8となっています。
従って\(H ^{+}を8つ\)反応物側に足すことによって水素の数が釣り合います。
\((MnO_{4})^{-}+8H^{+}→ Mn^{2+}+4H_{2}O\)
その四:電荷を電子で調整
最後に左右の電荷を電子\(e^{-}\)で調整すれば半反応式が完成!
電荷の偏りを調整します。
反応物側は +7、生成物側は +2より、電子e-を5つ反応物側に加えることによって、共に +2となって電荷も等しくなります。
\((MnO_{4})^{-}+8H^{+}+5e^{-}→ Mn^{2+}+4H_{2}O\)
始めは大変そうに見えますが、一度慣れれば丸暗記よりもはるかに効率よく、ミスなく半反応式を作ることができる様になるので、是非この方法をマスターして下さい!
酸化還元滴定の手順
さて、いよいよ実際に酸化還元滴定を見ていきます。
過マンガン酸カリウムと過酸化水素の滴定
過マンガン酸カリウムの滴定は、ヨウ素滴定と共に最も基本的で、かつ重要な酸化還元滴定です。
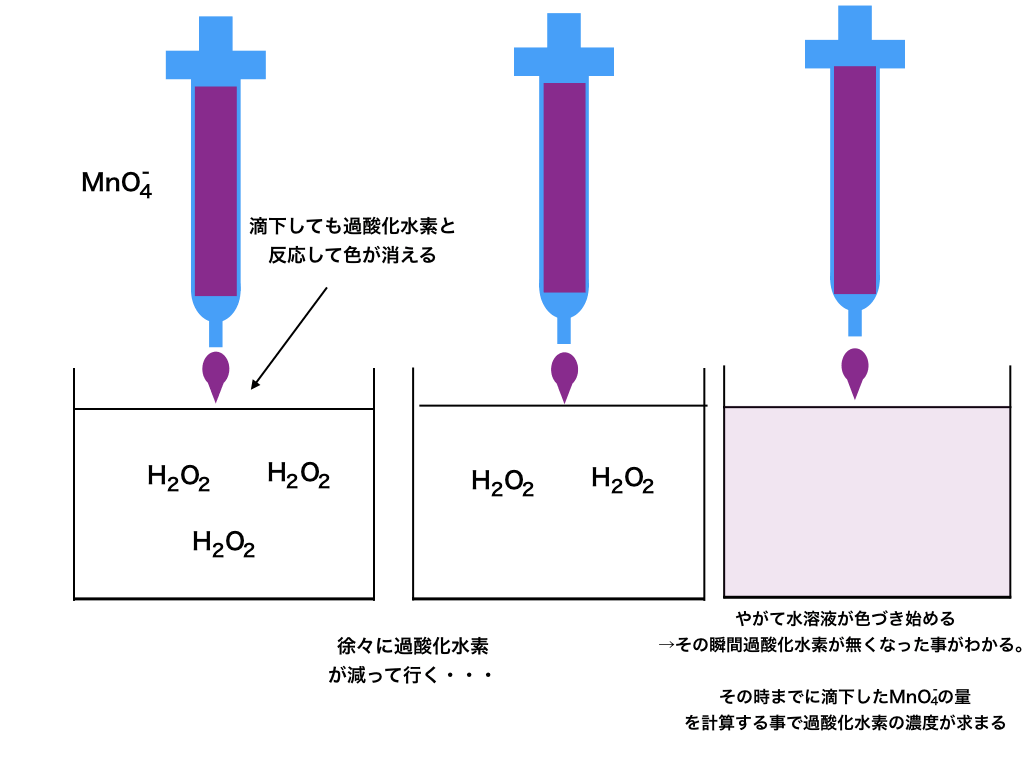
問:濃度不明の過酸化水素を50倍に薄め、その中から50mlを三角フラスコに入れて蒸留水と希\(H_{2}SO_{4}\)を加えた。(図の左端)
この溶液に0.05(mol/L)の過マンガン酸カリウム水溶液を滴定すると、20ml滴定した時点でフラスコ内が色付き始めた。(図の右端)
薄める前の過酸化水素の濃度を求めよ。
解答解説
この滴定の仕組みの解説
この滴定では、図のように水溶液が色付き始めた\(⇔(MnO_{4}) ^{-}\)の色が消えなくなった
=過酸化水素が全て反応した。
という風にして、指示薬なしで当量点が分かる様になっています。
希硫酸を加える理由
過マンガン酸カリウムは、酸性条件下でも中性条件下でも酸化剤として働きます。ではなぜ酸性条件にするのでしょうか?
\(酸性では、(MnO_{4}) ^{-}→Mn^{2+}\)
\(中性では、(MnO_{4}) ^{-}→MnO_{2}\)
大事な点は、過マンガン酸カリウムが単なる酸化剤だけでなく、指示薬の役割を果たしているということです。
\(Mn^{2+}\)は無色ですが、\(MnO_{2}\)は有色です。
という事は、中性条件下でこの滴定を行った場合、いつ当量点に達したか判断出来ないのです。
では、酸性条件にするなら塩酸でも硝酸でもいいのでは?
これも良く問われます。
結論から書くと塩酸は\(Cl ^{-}\)が還元剤として働き、硝酸は酸化剤として働く為に正確な滴定ができなくなってしまうので、そのどちらにもならない硫酸が使われるのです。
解答の手順
では本題に入ります。
まずは、過酸化水素と過マンガン酸カリウム(酸性条件下)の半反応式を作ります。
\((MnO_{4})^{-}+8H^{+}+5e^{-}\rightarrow Mn^{2+}+4H_{2}O\)
\(H_{2}O_{2}\rightarrow O_{2}+2H^{+}+2e^{-}\)
そして、過酸化水素の濃度をx(mol/L)とおき、
還元剤\(H_{2}O_{2}\)の放出した\(e ^{-}\)の数=酸化剤\((MnO_{4})^{-}の受け取るe ^{-}\)の数
となる様に立式していきます。
$$x\times \frac{1}{50}\times 0.05\times 2=0.05\times 0.02 \times 5$$
これを解いてx=2.5(mol/L)
従って、過酸化水素のmol濃度:2.5(mol/L)となります。
次回予告と関連記事
次回は、酸化還元滴定の応用編「ヨウ素滴定」から、「ヨードメトリーとヨージメトリー」を解説していきます。
この記事が基礎になるので、何度も読み返して復習しておいてください!
#2018/10/13更新
「CODとは?化学的酸素要求量の手順と問題の解き方を分かりやすく解説!」を作成しました!
<酸化還元とイオン化傾向の記事一覧>
酸化還元反応シリーズ
第1回:「酸塩基反応と酸化還元反応の違いを答えられますか?」
第2回:「イオン化傾向と酸化還元反応(電池)」
第3回:「ダニエル電池の計算問題とファラデー定数」
第4回:「電気分解とは?電池との違いと陽極/陰極でのルール」
第5回:「イオン化傾向とイオン化エネルギーの違いとは?」
第6回:「酸化剤と還元剤を酸化数を使って見分ける方法」
第7回:「アルミニウムの性質と酸化還元反応を利用した融解塩電解」
第8回:「今ココです」
>>「酸化還元分野の記事を総まとめ!」<<オススメです。
今回も最後までご覧いただき有難うございました。お役に立ちましたら、SNSでシェア&当サイト公式Twitterのフォローをお願いします!
質問・記事のリクエスト・誤植等はコメント欄、その他のお問い合わせ/ご依頼はお問い合わせページまでお願い致します。

