熱化学を0から学ぶシリーズ第3回~エネルギー図の基本・書き方と5つの原則~
さて、前回「熱化学シリーズ第2回:熱化学方程式と化学反応式」では“熱化学方程式”を学びました。
今回は、熱化学の中でも最重要、かつ最も苦手とする人が多い「エネルギー図」を紹介します。
エネルギー図をしっかりとかけるようになれば、熱化学を深く理解できるだけでなく、問題を解くスピードを圧倒的に早く、かつ、正確にすることができます。
今回は、そのための準備として、知っておくべき基本的なこと5つをまとめました。
ぜひじっくりご覧ください。
目次(タップした所へ飛びます)
熱化学の原則と「熱」と「エネルギー」の違い
熱化学では、〇〇熱や、△△エネルギーがたくさん登場します(さらに、電子親和力という”力とついていますが実質的には熱”も加わります)。これらの違いは一体何なのでしょうか?
この項では「熱」と「エネルギー」の2つを関連付けて説明することによって、熱化学の問題を簡単に解くための基礎知識を紹介していきます。
【大原則】全ての物質は安定した状態を好む
このことについては、<参考:「電気陰性度と電子親和力・イオン化エネルギーの違いを解説!」>でも詳しく書いているのですが、
閉殻ではない“電子が欠けた状態”で、あと1〜3個程度の電子を取り込めば【希ガス型】になれる原子は、電子を取り込み『陰イオン』に、
逆に電子が少し多いために、希ガス型の電子配置を取れない原子は、電子を放出して『陽イオン』になろうとします。
このように、全ての物質はより安定した状態になりたいため、それを妨害する(共有結合を切り離したり・・・)ためには『エネルギー』が必要となり、
逆に何らかの反応によって、安定した状態になればその分を『熱』として放出します。
原則1:熱とは
反応熱というのはその名の通り、「○○という反応をすると発生する熱」という意味になります。
したがって、反応の結果出る熱なので、熱量は生成物側である(右辺)に書くことになります。
例えば”物質Aと物質Bが反応して物質ABができ、Q (kJ) の熱が発生する”という、
最も基本的な場合を考えると、以下のような式で表されます。(物質の状態は省略しています。)
A + B = AB + Q(kJ)
原則2:熱化学におけるエネルギーとは
一方、熱化学で扱うエネルギーとは、ある物質を”不安定な状態”にするために加えるエネルギーのことを指します。
“全ての物質は安定を好む”ので、それをあえて不安定にするには、その分熱量を加える必要があるのです。
つまり、反応物側の(左辺)に熱量を加えます。
例として、E (KJ) のエネルギーによって、物質CDが物質Cと物質Dの2つに分かれた場合を見てみます。
このとき、熱化学方程式は次のように表されます。
CD+ E (KJ) = C+D
エネルギー図の書き方(基礎)
さて、ここからは実際に基本的なエネルギー図の書き方を解説していきます。
エネルギー図ではエネルギーの高いものを上へ、エネルギーの低いものを下へと書いていきます。
(=不安定な状態のものほど上へ、安定した状態のものほど下に書く)
具体的な物質の状態で言うと、エネルギーの高い順に
(不安定である)
イオン>
原子>
単体>
化合物>
完全燃焼後に残った物質>
水和物となります。
(安定している)
例えば、電子を失った水素イオン(H+)よりも、水素原子(H)の方が安定し、更にH2の様に共有結合している単体の方が更に安定している、という事です。
考えてみると当たり前だと感じるのではないでしょうか?この様なイメージで、残りの順序も覚えてしまってください。
ではここまでの前提を踏まえつつ、先ほどの「熱」と「エネルギー」について、それぞれエネルギー図を実際に書いていくことにしましょう。
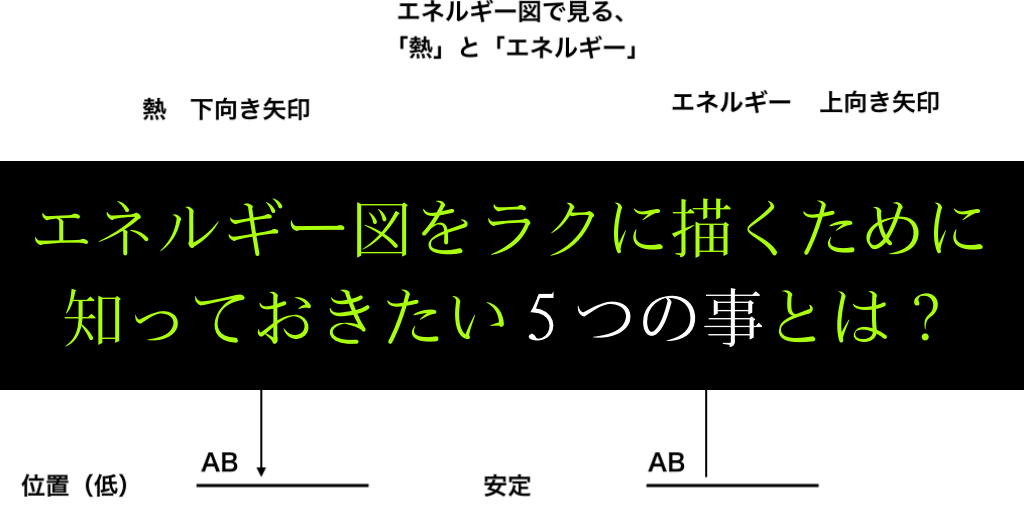
原則3:まずは「熱」です。
エネルギー図は下に行くほど安定であるというのは先ほど述べた通りです。
したがって、反応すると「出る熱」であるOO熱は、
『基本的に、安定した状態である下方向を目指す』と考えて、矢印を下向きに書きます。
そして矢印の横に熱量を記してください。以下のような図(の左側)となります。
<エネルギー図1:熱(左側)>
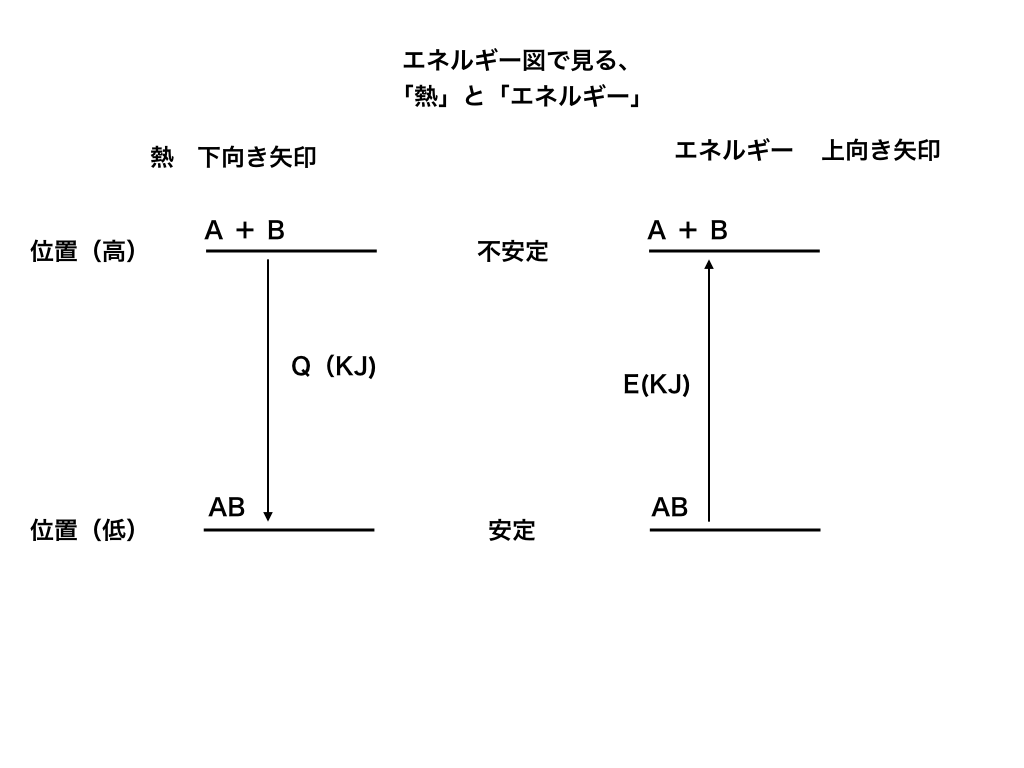
原則4:次は「エネルギー」です。
先ほど述べた通り、エネルギー図では、
上に行くほど物質がバラバラ(=不安定)であるということを意味します。
したがって、不安定な状態を目指す××エネルギーについては、
矢印を上向きに書いて、その横にエネルギーの量(KJ)を書くようにしてください。

<図(再掲)2:エネルギー(右側)>
次回(2019/01/23現在作成中です。)→作成しました。以下のリンク、もしくはこのページの最後にある、シリーズの記事一覧のところからご覧ください。「熱化学(4):6種類の熱&3種類のエネルギーを徹底解説!」各々の熱やエネルギーについて、一つ一つエネルギー図を書いて詳しく説明します。
まずは、この2つの区別をしっかり付けるようにしましょう。
原則5:熱とエネルギーの例外(状態変化に関する”熱”)
ここまで紹介してきたように、「熱」と「エネルギー」に関するエネルギー図は、基本的には上記のようになるのですが、いくつかの例外があります。
それが、状態変化を表す熱である昇華熱、融解熱、蒸発熱です。
これらは語尾が〇〇熱ですが、××エネルギーとして扱うので、特に注意が必要です。
すなわちこれらの熱は、
・熱化学方程式では左に熱量を書き、
・エネルギー図では、矢印を上向きに書くようにします。
具体例として、水の蒸発熱を熱化学方程式とエネルギー図で表してみます。
H2O(液)+42 (KJ) = H2O(気)
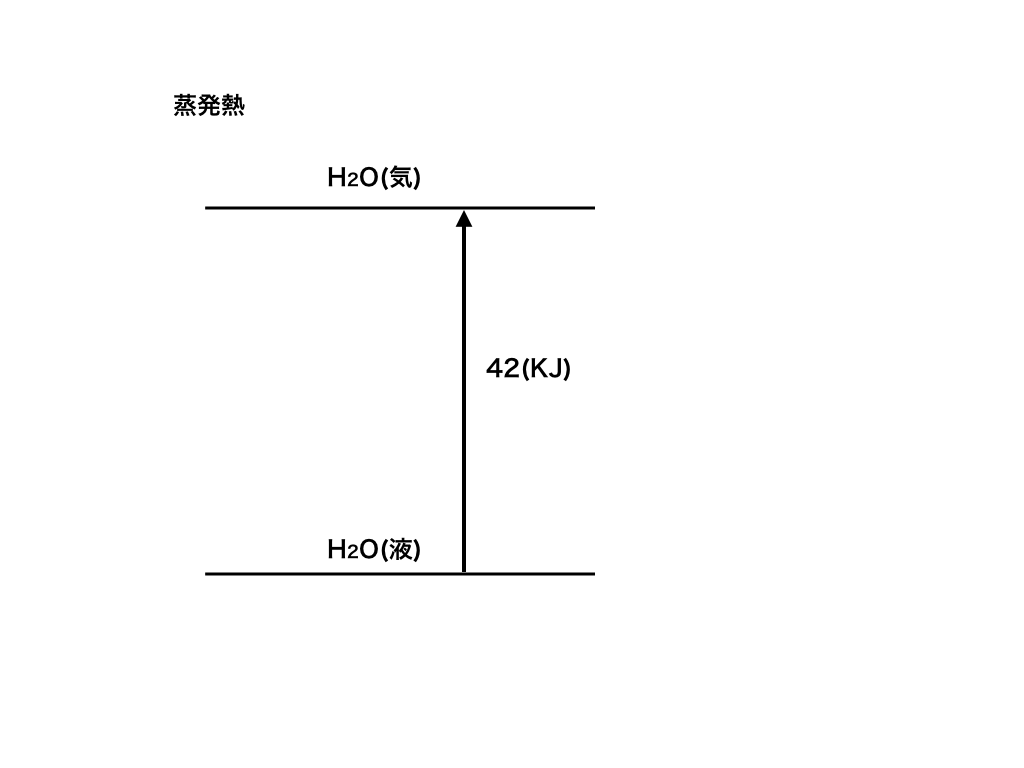
<水の蒸発熱のエネルギー図>
これは、『液体の水に熱量(42KJ)を加えると水蒸気(H2Oの気体の状態)になった』、
ということを表しており、感覚的にも一致するのではないでしょうか。(コンロで水を熱し続けると、すべて蒸発してしまうイメージです。)
他の2つ(凝固熱・融解熱)に関しても同様に考えてください。
少しややこしいですが、”「上はバラバラで不安定、下は安定」の原則”を思い返してみると、多少理解しやすくなるはずです。
エネルギー図を書く為の原則まとめ
・その一:エネルギー図は上が不安定でバラバラ、下が安定
・その二:エネルギーの高い順(不安定な順)に、イオン>原子>単体>化合物>完全燃焼後に残った物質>水和物となる
・その三:熱化学方程式において、「熱」は熱量を生成物側(右辺)に、エネルギー図では矢印を下向きに表記する
・その四:その三同様、熱化学方程式では、「エネルギー」は熱量を反応物側(左辺)に、エネルギー図では、矢印を上向きに表記する
・その五:蒸発熱、融解熱、昇華熱は実質的には「エネルギー」と同じように扱う
ここまでは「熱」と「エネルギー」、そのエネルギー図の書き方について、一つ一つ紹介してきました。
次回以降(詳しい熱・エネルギーの種類の理解(第4回)や、エネルギー図を使って複雑な問題を解く方法(第5回))の、大前提となる内容なので、しっかりと理解しておきましょう。
熱化学を0から学ぶシリーズ一覧
第一回:「シリーズ第1回〜熱化学を学ぶためのイントロダクション〜」
第二回:「熱化学方程式と、化学反応式の違いをわかりやすく解説」
第三回:「今ココです」
第四回:「3種類のエネルギーと6種類の熱を網羅!」
第五回:「ヘスの法則&エネルギー図を使った熱量の求め方」
最後までご覧いただきまして、有難うございました。
当サイト「スマナビング!」では記事のリクエストや、ご質問・ご意見を募集しています。ぜひコメント欄にお寄せください。
引き続き関連記事をご覧ください!

