
熱化学シリーズ第4回:さまざまな熱とエネルギー
熱化学の問題を解くとき、たくさんの種類の熱・エネルギーが出てきて覚えきれなくなっていませんか?
また、溶解熱と水和熱の様に似ている様で違うものの相違点を答えられますか?
この記事では、6種の熱と3種類のエネルギーを整理して、エネルギー図や熱化学方程式を解く際に必要な知識をカバーしました。
ぜひじっくりとご覧ください!
(この記事は、「熱化学(3)エネルギー図の書き方が分かる!」の続編です。)
目次(タップした所へ飛びます)
6種類の熱一覧
さて、前回はエネルギー図の基本を扱いましたが、しっかり理解することができましたでしょうか。今回は前回学んだことの応用として、各々の熱・エネルギーの意味について解説していきます。
覚えるべきpoint:反応の元fromと反応後to、基準とする物質
それぞれの熱・エネルギーについて解説する前に、気を付けておくべき「2つのポイント」を紹介しておきます。
・fromとtoはどこ(どの物質)か?
・何を基準の1molにするか?
まず1つ目について。エネルギー図を書くときには、矢印の端(元)から先がどこかをしっかりと理解していなければなりません。「どの状態から(from)反応がはじまり、どの状態で反応が終わるか(to)」をしっかりと覚えておくことが大切です。
次に2つ目の「何を基準の1molにするか」についてです。
これは熱化学方程式を書く際にも重要な内容です。
熱化学方程式に書き込む熱量(KJ)は、基準となる物質1molが変化(イオン化したり、溶解したり・・・)するときの熱量を指します。
生成熱
from: 単体
to: 化合物
基準:化合物(生成物)
生成熱とは、単体からある化合物1(mol)が生成されるときに生じる熱のことを言います。
(例)NH3の生成熱
~熱化学方程式~
1/2N2(気) + 3/2H2(気) = NH3(気) + 46(kJ)
<熱化学方程式で係数が分数になる理由を覚えていますか?第2回で解説しているので、あいまいな人は復習しておきましょう!→「熱化学方程式と化学方程式の違い」>
燃焼熱
from: 単体 or 化合物
to: 完全燃焼
基準:単体 or 化合物(燃焼する反応物)
燃焼熱とはある物質1molが完全燃焼した際に生じる熱のことを表します。
(例)CH4の燃焼熱
~熱化学方程式~
CH4(気)+ 2O2(気) = CO2(気) + 2H2O(液) + 830(kJ)
中和熱
from:酸の水溶液と塩基の水溶液
to: 化合物
基準:中和して生じたH2O
中和熱とは、酸の水溶液と塩基の水溶液を中和させたときに生じる熱のことを指します。
ここでひとつ注意すべきなのは、左辺はどちらも水溶液の状態であるということです。時折固体の水酸化ナトリウムにしてしまうミスなども見られますので注意しましょう。
(例)塩酸と水酸化ナトリウム水溶液の中和熱
~熱化学方程式~
NaOH aq+ HCl(液) = NaCl(液) + H2O(液) + 56 (kJ)
溶解熱
from: 単体 or 化合物
to: 溶媒和(水の場合、水和状態)
基準:単体 or 化合物
溶解熱とは、ある物質1molが多量の溶媒(主にaq)に溶けた時に生じる熱のことを指します。
(例)塩酸の溶解熱
~熱化学方程式~
HCl(気) + aq = HCl(液) + 75(kJ)
水和熱
from: イオン(気体)
to: 水和状態
基準:イオン(気体)
水和熱とは、気体状態のイオン1(mol)が水和状態になるときに生じる熱のことを指します。
溶解熱と似ているために混同してしまいがちなので、注意して区別しておきましょう。
(例)ナトリウムイオンの水和熱
~熱化学方程式~
Na+(気) + aq = Na+(液)+ 404(kJ)
<※”単体/化合物”にaqが +された溶解熱と違い、”イオン”にaqが +されています。>
電子親和力
from: 原子(気体)
to: 陰イオン
基準:原子(気体)
電子親和力とは、気体状態の原子に電子を一つ加えて陰イオンにした際に生じる熱のことを指します。名前に「熱」という文字は入っていませんが、熱として扱うので覚えておきましょう。
<参考:「電気陰性度と電子親和力・イオン化エネルギーの違いを解説」>
(例)Clの電子親和力
~熱化学方程式~
Cl(気)+ e-(気) = Cl-(気) + 394(kJ)
3種類のエネルギー一覧
ここまでは、『〜熱』について見てきました。次は『〜エネルギー』です。このシリーズでも何度か紹介していますが、
〜熱は
・熱化学方程式において、基本的に熱量(KJ)は生成物側(右辺)に書き
・エネルギー図を書く時は矢印を下向きに書き込みます。(不安定な状態から安定した状態へ向かう)
一方で、〜エネルギーは
・熱化学方程式で、熱量(KJ)を反応物側(左辺)に書き
・エネルギー図では矢印を上向きに書き込む(安定した状態から不安定な状態に向かう)
この2つに違いをよく注意しながらエネルギーを見ていきましょう。
結合エネルギー
from: 共有結合
to: 原子(気体)
基準:共有結合
結合エネルギーとは共有結合している物質1(mol)をバラバラにして、"原子"と"原子"に"切り離す"際に必要なエネルギーのことを指します。
どの原子間の結合なのかによってその大きさも様々です。(大体の場合、問題を解く際に必要な結合エネルギーは問題で表として与えられています)
理論分野の結晶や有機分野と絡めて出題がなされることも多いのが結合エネルギーです。
(例)水素H2をH原子2つに切り話す際に必要な結合エネルギー
~熱化学方程式~
H2(気)+ 436(kJ) = 2H(気)
格子エネルギー
from: 結晶
to: 構成粒子(気体)
基準:結晶
格子エネルギーとは、結晶を気体の構成粒子までバラバラにするために必要なエネルギーのことを指します。
(例)NaClの格子エネルギー
~熱化学方程式~
NaCl(固) + 778(kJ) = Na+(気) + Cl-(気)
イオン化エネルギー
from: 原子(気体)
to: 陽イオン(気体)
基準:原子(気体)
(第一)イオン化エネルギーとは、気体原子から電子を取り去って陽イオンにするときに必要なエネルギーのことを指します。
<参考:「イオン化エネルギーとイオン化傾向の違いとは?」>
(例)ナトリウムのイオン化エネルギー
~熱化学方程式~
Na(気) + 494(kJ) = Na+(気) + e-
今回のまとめと熱化学シリーズ
・種類は多いですが、何度か読み直してそれぞれの熱orエネルギーの"出発点"と"到達点"、"基準とする物質"をしっかり答えられるようにしておきましょう。
・次回以降のエネルギー図を使って熱量を計算する際に、1つでも曖昧だと解けなくなってしまう事があります。
今回登場した、熱とエネルギーをまとめてエネルギー図に書き込むと、次のように表すことができます。(一部省略しています)
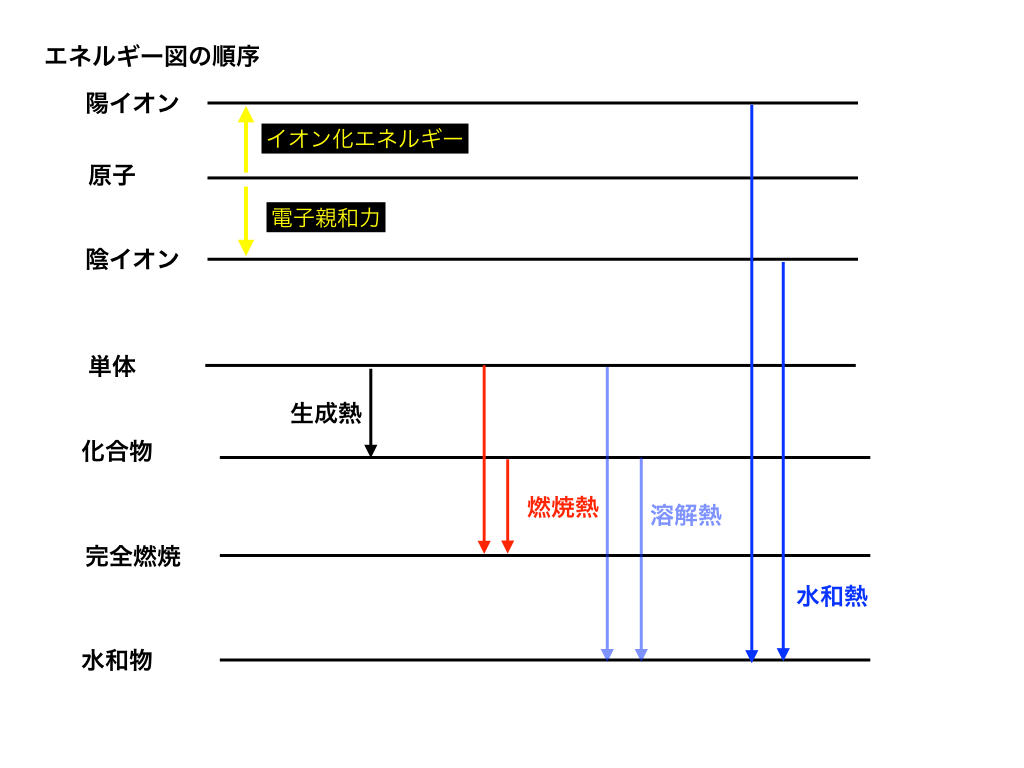
<熱とエネルギーをエネルギー図で復習>
熱化学を0から学ぶ!シリーズ一覧
第1回:「熱化学シリーズ〜イントロダクション〜」
第2回:「熱化学方程式と化学反応式の違い」
第3回:「エネルギー図の書き方と5つの知識」
第4回:「今ここです」
第5回:「ヘスの法則とエネルギー図を使って問題を解く方法」
今回も最後までご覧いただきましてありがとうございました。
「スマナビング!」では、皆さんの記事のリクエストや質問、ご意見をお待ちしています。ぜひコメント欄までお寄せください。
また、いいね!やB!、シェア、公式Twitterのフォローをしていただけると助かります。
・その他の問い合わせ/ご依頼に関しましては、お問い合わせページよりお願い致します。

