
”反応速度定数”の求め方とよくある質問
<この記事の内容>:『反応速度定数』に関する注意点と、その求め方をまとめ、『化学平衡(定数)』との関連や,相違点などを解説しています。
(平衡の知識が多少あると理解しやすいので、以下の記事をあわせて読んでおくと理解がはかどります)
<関連記事>:「化学平衡の基礎と"Kc"("濃度"平衡定数)」
速度定数の”意味や計算”から、”実験データを読み取る方法”を例題で解説していきます。
目次(タップした所へ飛びます)
反応速度(定数)とは何か
反応速度とは、その名の通り『反応物』が『生成物』に変化する際の”速さ”であり、速度定数は\(v_{1}=k_{1}[A]^{\alpha}[B]^{\beta}\)の式の“\(k_{1}\)”にあたる数です。(以下の項で詳説します。)
反応速度"定数"の求め方と注意点
ここでは、反応速度式を作るにあたって重要なことを確認しておきます。
V(反応速度)とk(反応速度定数)

反応速度定数を求める際に、「【平衡定数】を求める場合」と同じ要領で、化学反応式の”係数”を濃度の●乗する人が非常に多いです。
反応式の係数=モル濃度の●乗ではない!
平衡状態は正反応と逆反応が釣り合った時のことなので、平衡定数「Kc」や圧平衡定数「Kp」と同様にしても良さそうに思えるのももっともです。
では何故ダメなのか。
実は化学反応が起こる過程では、様々な段階を経て反応物が生成物に、またその反対の反応が起きているためなのです。
逆に、1段階の反応であれば(これを素反応と言います)、平衡定数と同様の方法で反応速度・および定数を求めることができます。
化学平衡と物質量保存則
そうすると、次の疑問が出てくる人もいるでしょう。「そもそも平衡定数も素反応の時しか係数乗してはいけないのでは?」と。
これは非常に良い着眼点なのですが、その解説は高校化学の域を超えてしまいます。
したがって詳細は控えますが、『化学平衡の場合』は「多段階の反応でも」”質量保存の法則”が成り立つことが分かっているのです。

ではここからは、正・逆反応の視点から平衡状態を見ていきましょう。
正/逆反応の速度定数からKc(平衡定数)へ
下の図でまとめているように、可逆反応(『生成物→反応物』の”逆反応”も同時に起こる反応のこと)においては、”正反応の速度”=”逆反応の速度”というふうに反応速度が釣り合った時、『平衡状態』と呼びます。
つまり、\(\alpha A+\beta B \leftrightarrow \gamma C\)の反応速度が一致する場合を見ていきます。
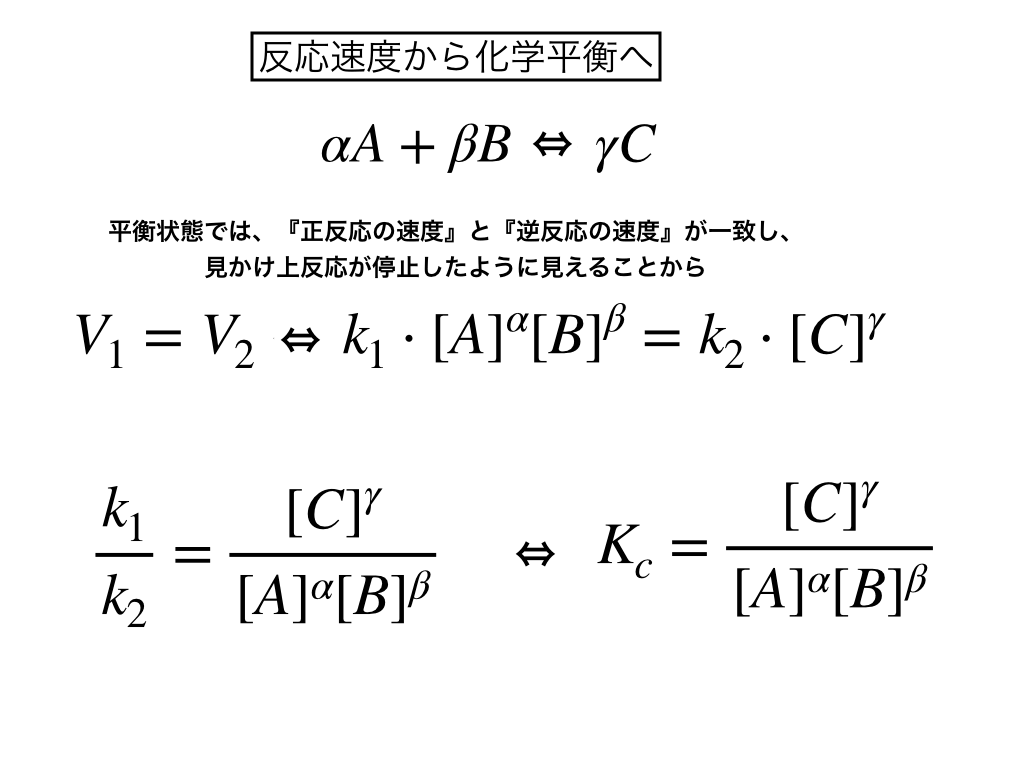
\(すると、V_{1=正反応}=k_{1}[A]^{\alpha}[B]^\beta\)
\(V_{2=逆反応}=k_{2}[C]^{\gamma}\)
から、それぞれをイコールで結ぶと、
\(V_{1}=V_{2}\)
\(k_{1}[A]^{\alpha}[B]^\beta=k_{2}[C]^{\gamma}\)
$$\frac{k_{1}}{k_{2}}=\frac{[C]^{\gamma}}{[A]^{\alpha}[B]^\beta}$$
$$この\frac{k_{1}}{k_{2}}=K_{c}$$
が正・逆の”速度定数”と”平衡定数”をつなげます。
反応速度式の問題と解答
ここでは、上記の内容を確認する『基礎レベル』の問題を取り上げ、解説していきます。
濃度と速度のデータが与えられている問題
このパターンの問題は、自分で”べき乗”の部分を表から読み取る必要があるので、よく出題されます。
問題;いま(A)と(B)が反応して(C)となった。以下の表から、生成物の濃度と反応速度の関係を読み取り、反応速度定数を求めよ。
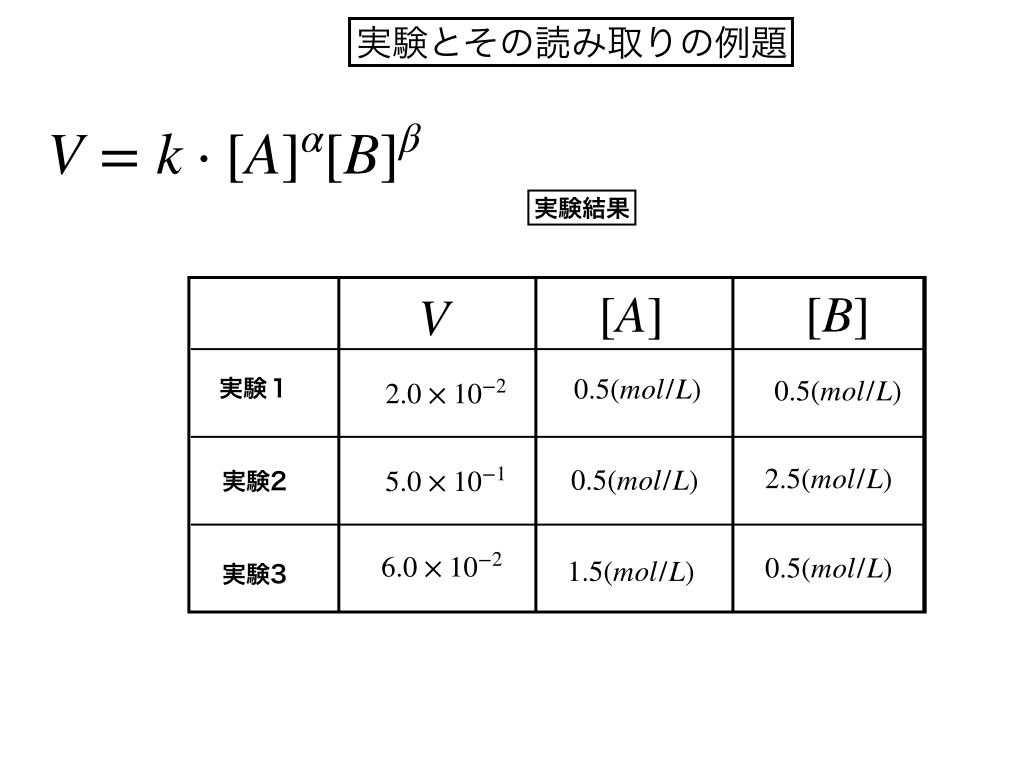
解答・解説
この様な表が出てきたら、以下の様にしてkを求めていきます。
(1)3つの実験(それ以上の場合も勿論あり得ます)の中から2つの実験に注目する。
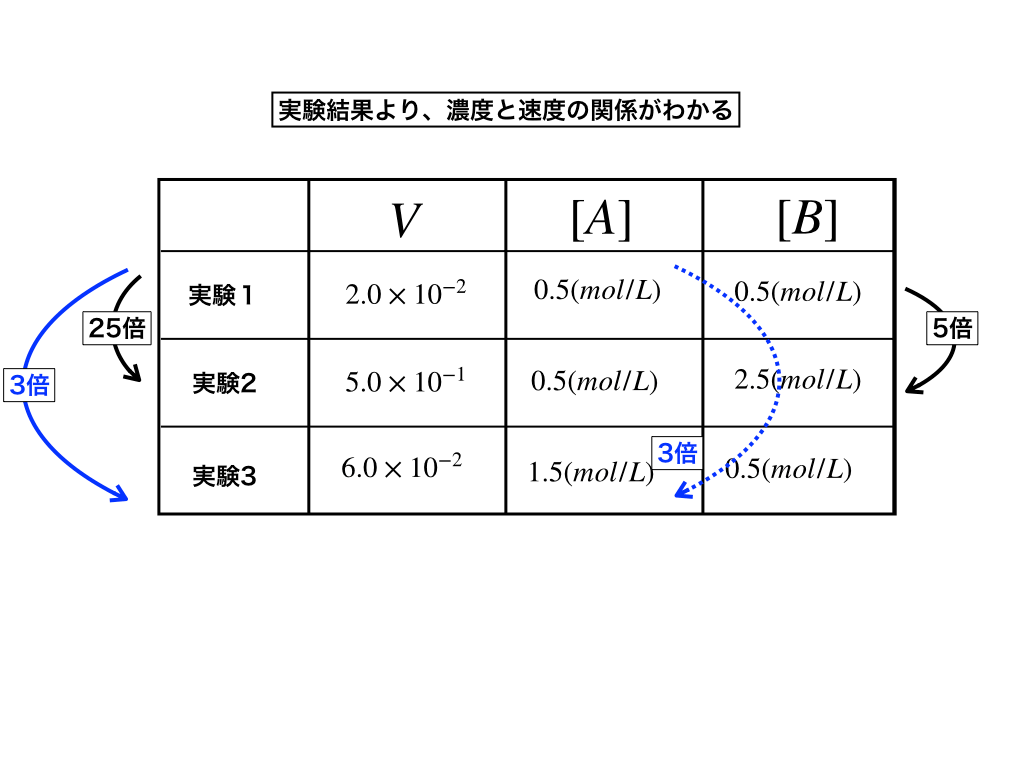
(2)具体的には、表のように「(実験1)と(実験2)」、「(実験1)と(実験3)」の2つに分けてそれぞれの濃度とVを比べていきます。
すると、黒の矢印では、[A]は0.5(mol/L)で一定ですが、Bの濃度が0.5(mol/L)から2.5(mol/L)へと5倍になっており、その時Vは\(2.0\times 10^{-2}から5.0\times 10^{-1}\)へと25倍に変化しています。
つまり、Vは(実験1)と(実験2)から、Bの濃度の2乗に比例する事がわかります。
(3):次に残りの(実験1)と(実験3)の青矢印の部分に注目すると[B]は一定、Aは0.5(mol/L)から1.5(mol/L)へと3倍になり、この時Vは\(2.0\times 10^{-2}から6.0\times 10^{-2}\)へと3倍になっています。
よって、VはAの濃度の1乗に比例します。
(4):(2)と(3)の結果を合わせる
以上より、\(v=k\times [A]^{1}[B]^{2}\)と指数部分が定まり、実験の値を代入する事で
\(5.0\times 10^{-1}=k\times 0.5\times 2.5^{2}\)
よって、\(k=1.6\times 10^{-1}\)・・・答
今回のまとめ
・”平衡定数”と”反応速度定数”の求め方の違いに注意する。
・なぜ係数比を使って速度を求めて良い場合と、そうでない場合があるのか説明できるようにしておく。
・実験結果の表から【反応速度定数】を計算できるように、解法を確認する。
・活性化Eと触媒などの用語・グラフを復習しておく
以上のことがマスターできれば、次は『Kc濃度平衡定数』や、『Kp:圧平衡定数』、電離平衡などの平衡シリーズに進みましょう↓
関連記事(平衡シリーズ・ルシャトリエの原理)へ
左右に平衡が移動する問題で必須の『ルシャトリエの原理』。
が、種類が多い上、丸暗記をしてしまうと
・『どっちが増える/減る』と
・『どちらに移動するor移動しない』
のか分からなくなりやすいです。
「平衡を移動させる”ルシャトリエの原理”を全パターンまとめ」では、”イメージと理解”によって『覚えず』正確に、平衡移動を考えられるように詳しく解説しています。
平衡シリーズ~Kc,Kp,Kh,,,~
平衡の”基礎”:「濃度平衡定数【Kc】の意味と求め方」
”圧力”バージョン:「圧平衡定数【Kp】の求め方と【Kcとの変換・対応】関係」
”酸塩基”との融合:「弱酸・弱塩基のpHと電離平衡の問題」
今回も最後までご覧いただき、ありがとうございました。
・『スマホで学ぶサイト、「スマナビング!」』では、読者の皆さんのご意見,ご感想の募集をコメント欄で行なっています。
(※:問題の解き方や証明等、個々のリクエストについては対応できない事があります。ご了承ください。)
・その他の「お問い合わせ/ご依頼」に付きましては、【運営元ページ】よりご連絡をお願いいたします。

