
炎色反応とその覚え方・原理
<この記事の内容>:無機化学において、金属イオンの検出反応に用いられたり、身近なところでは花火の発色をする原理となっている『炎色反応』について、高校化学と物理の範囲で詳しく解説していきます。
目次(タップした所へ飛びます)
炎色反応とは
まずは炎色反応の実験の仕方から紹介していきます。
炎色反応の実験の目的と手順
金属イオンの系統分離問題では、沈殿させたり試薬を用いたりしながら、それぞれのイオンを分析していきます。
しかし、一部の金属イオンは沈殿↓も試薬にも反応しないことがあります。
また、有機化学における”構造決定問題”ではC,N,H,O以外の元素を調べる時があります。
そう言った場合、イオンが溶けている溶液を以下の手順で分析します。
塩酸での洗浄
白金(プラチナ)製の金属線の端を塩酸で洗ったあと、ガスバーナーに入れるという操作をはじめに数回行います。
(白金線に「試料となる金属イオン」以外のイオンがついていないようにする為)
白金線に試料を付けて外炎部へ
白金線が洗浄され、(=ガスバーナーに入れても色が変化しなくなったら)いよいよ実際に溶液(イオンを含んだ液体)を付けて、ガスバーナーの外炎部に入れます。
すると、それぞれの金属ごとに固有の色の炎が確認できます。
金属別の炎色反応の一覧
以下の<図1>に、必ず覚えておく必要がある金属とその炎色反応についてまとめました。
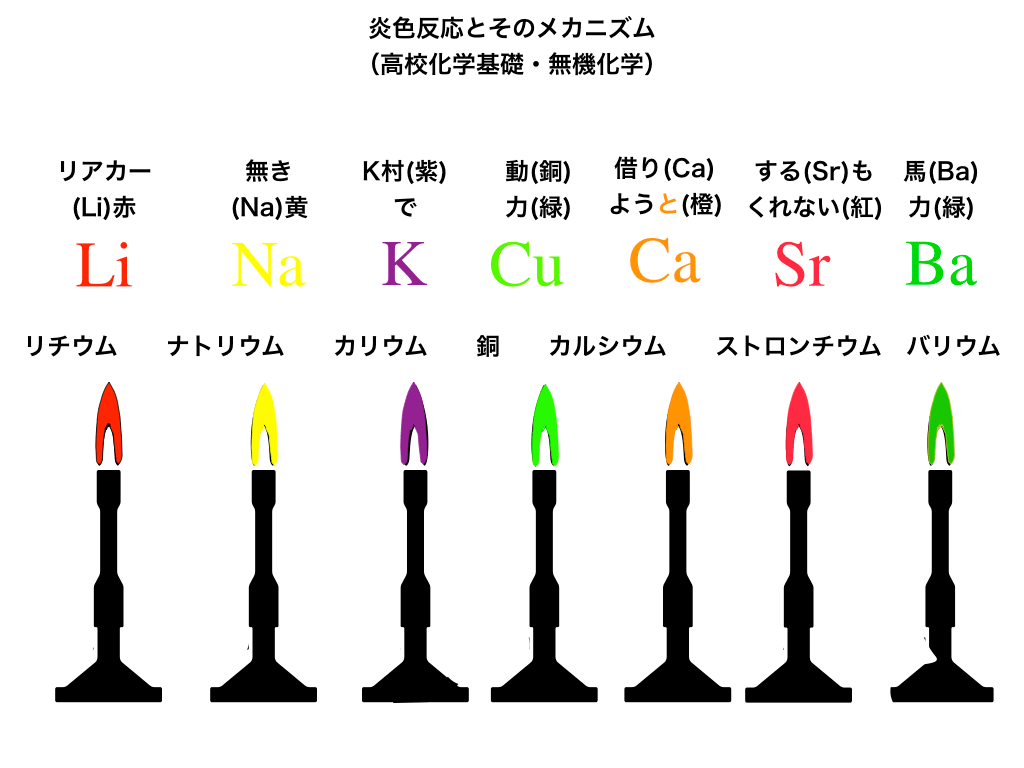
<図1:主な炎色反応>
炎色反応の覚え方(色とゴロ)
金属イオン→炎色反応の色の順に並べると、
\(\mathrm{Li ^{+}赤、 Na ^{+} 黄、 K ^{+}紫、 Cu ^{2+} }\)青緑、
\(\mathrm{ Ca ^{2+} 橙(だいだい色)、 Sr ^{2+}紅(くれない色)、 Ba ^{2+} }\)黄緑
(はじめのリチウム〜カリウムまでは【アルカリ金属元素】、銅をはさんで、カルシウム〜バリウムまでは2族の【アルカリ土類金属】です。)
注意点は、”銅の緑”と”バリウムの緑”は違うこと、Srは”ストロンチウム”であるということくらいです。
覚え方として何種類か有名なゴロ合わせがあります。上のイラストにも書いているので、気に入れば利用してください。
(自分でゴロを作ることもオススメです。他作のゴロよりも自作の方がより忘れにくくなるからです。)
検出反応など炎色反応の利用例
・無機化学のイオンの系統分析で、沈殿しない液体に含まれる金属イオンの特定
・他にも、有機構造決定での金属の検出など
炎色反応の原理/仕組み
ここまでで基礎的な炎色反応についての説明は終わっているのですが、『なぜこのような炎色反応が起こるのか?』、その原理を問われることがあります。
その理由を高校物理(・化学)の範囲で解説していきます。
ボーアの水素モデル(準備)
準備として、「水素イオンのエネルギー準位と線スペクトル」を読んでもらうと話が理解しやすいかと思います。
熱エネルギーによる励起(れいき)
まず、試料となる金属(イオン)を白金線にのせ、バーナーで加熱します。(上述した実験の手順通り)
この時、ガスバーナーの熱エネルギーによって、内側の電子殻から電子にエネルギーが加わり外側の電子殻へと移動します。
これを「励起(”れいき”)」と呼びます。
ここで、「熱化学:基本的な考え方を解説」でも紹介しているのですが、
エネルギーが高い状態=不安定な状態であり、物質はなるべく安定な状態に戻ろうとします。
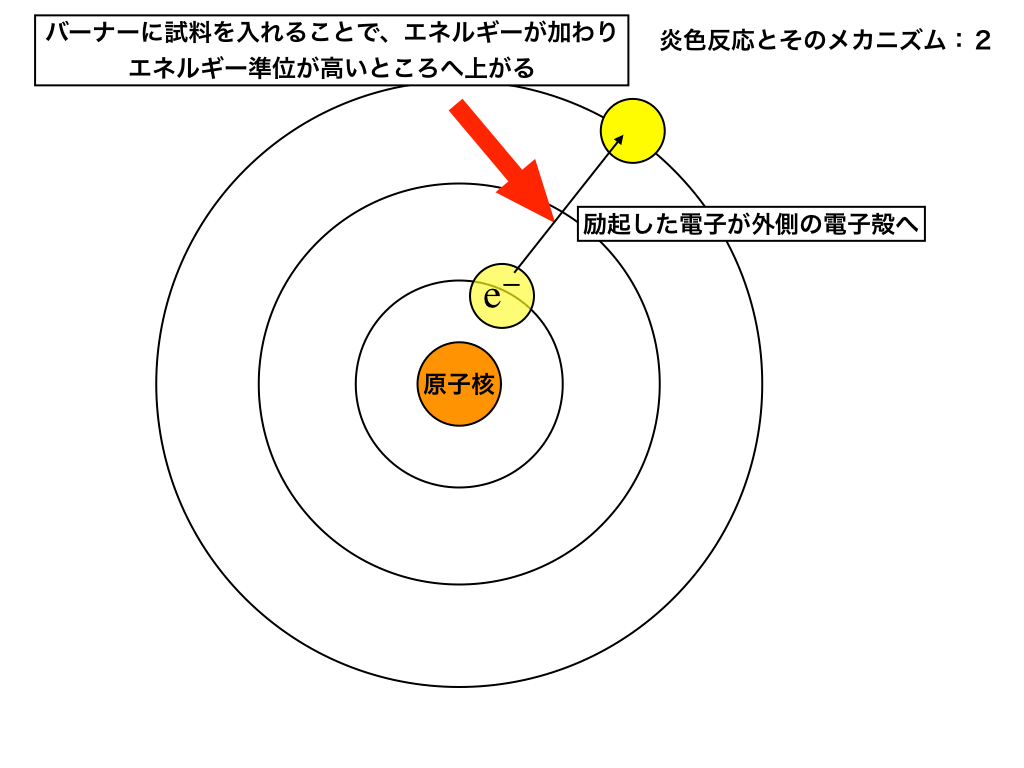
<励起した電子の様子>
電子軌道間の”落下”とエネルギー変化
前項からの続き:不安定な(エネルギー準位の高い)外側の電子殻中にある電子は、エネルギーを放出しながら再び内側の電子殻へと”落下”し始めます。
この時のエネルギーの差分が、電磁波(波長は元素によって異なるが、今回紹介している元素は可視光の範囲の波長です)として放出されます。
(電磁波については:右のページの→「光波の干渉実験:光の波長と可視光線」でも解説しています。)
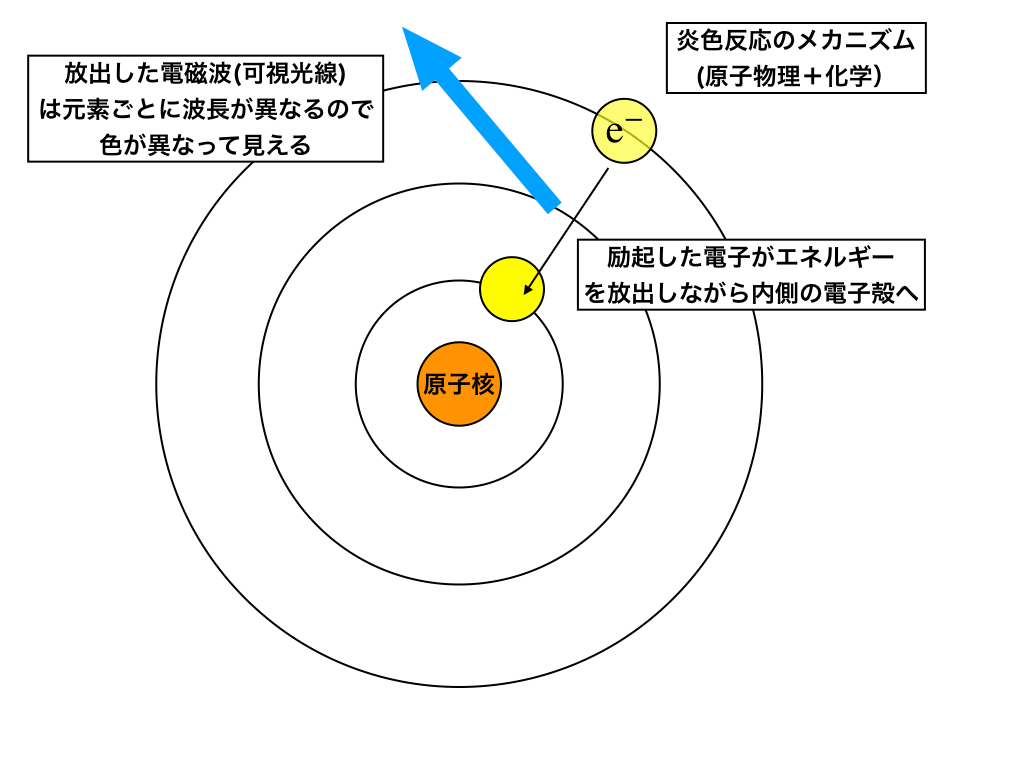
<励起状態→基底へ>
エネルギー変化と可視光の放出
これによって、その元素固有の波長の可視光線が観察されるので『炎色反応』として元素・原子の特定に利用できるわけです。
炎色反応まとめ
・有機・無機ともに、複雑な元素分析において炎色反応は大変強力なツールとなります。
・ぜひ仕組み(原理)とともに理解した上で、うまくゴロを使って覚えていきましょう。
関連する無機・原子物理の記事へ
最後までご覧いただきまして、有難うございました。
【受験/学習メディア】:「スマナビング!」では、皆さまからのご感想をコメントにて募集しています。
(※:個々の問題の質問等、対応出来ないことがあります)
・ご依頼/タイアップ等に関しては「運営元ページ」よりご連絡下さい。

