
COD:化学的酸素要求量
(酸化還元反応まとめのうちの第11回目)
何がしたいのかよくわからない、「COD」の目的と仕組み、入試にも対応できる計算方法を徹底的に説明していきます。
また、あまり解説されておらず、手薄になりがちな「ブランクテスト(実験)」も紹介しています!
<先に読んでおきたい記事>:「酸化還元滴定の仕組みと半反応式の覚え方・作り方を徹底解説」
さて、化学の問題集を開いてみると、酸化還元反応の単元で必ずと言っていいほど、COD(化学的酸素要求量)が出てきます。
CODは手順が非常に煩雑で、出題される時も長文となるので苦手に感じる方も多いと思います。
ただ、一度方法を理解してしまえばスラスラ解けてしまう上、問われる事は変わらないので、一度身につけてしまえば周囲に差を付ける事が出来ます。
今回はそのCODについて、例題や図を用いて詳しく解説します。
目次(タップした所へ飛びます)
CODとは?=化学的酸素要求量:その目的と意味
CODはChemical(化学的)Oxygen(酸素)Demand(需要=要求量)の頭文字をとったもので、酸化還元反応を利用して、試料水がどれほど汚染されているかを調べる方法です。
水質汚染と酸素量
もう少し詳しく説明します。COD(=化学的酸素要求量)とは『水中にどれだけの有機物があるのか』を酸素の量に換算して数値化したものです。
有機物が水中に沢山存在すると、バクテリアなどの微生物が大量の酸素を使い分解しようとするために、水中の酸素濃度が一気に低下します。
この状態がまさに赤潮=水質汚染ですね。
従って、水中の有機物の量を測るというのは、その川や湖の水質調査をしているということになります。
よってCODは河川の水質の指標となっているのです。基本的には試料水1L中の有機物を酸化するために必要な酸素の質量(mg)で示すことが多いです。
CODの試薬が過マンガン酸カリウムな訳
しかし、酸素の量は直接測れないので、代わりに過マンガン酸カリウムとシュウ酸を使って滴定し、以下の手順を踏んで、酸素の量を計算します。
酸化還元滴定には大きく分けて過マンガン酸カリウムを利用する方法とヨウ素・ヨウ化カリウムを利用する2種類がありました。
「ヨウ素滴定の仕組みと種類(作成中)」
これは、酸塩基反応の中和滴定の試薬に相当するものが、高校範囲の酸化還元反応では存在しない為です。
そのかわりに、酸化剤と還元剤のそのものの色を利用するので、それに適したものが過マンガン酸カリウムとヨウ素だった訳です。
では、何故過マンガン酸カリウムを使ってヨウ素を使わないのか?
勘のいい人は気付いているかも知れません。
ヨウ素滴定はデンプンを使って反応を確認します(ヨウ素デンプン反応)。
このデンプンは有機物です!
有機物を調べる為に有機物を加えたら、正しく汚染度を測ることができません。
従って、過マンガン酸カリウムしか利用できないというわけです。
CODの手順を問題を使って解説
酸化還元滴定の仕組みは理解しておく必要があるので、
苦手な人は先に→「酸化還元滴定を初めから解説!半反応式の作り方から演習問題まで」で
酸化還元滴定の基本をマスターしておいて下さい!
<COD測定の手順を試験問題を使って解説>
河川などの水質汚濁の主な原因として、工場排水や家庭雑排水に含まれる有機化合物が考えられる。この有機化合物の量を表すのに、化学的酸素要求量(COD)を指標とすることがある。
CODとは、試料1Lあたりに含まれる有機化合物を酸化するために必要な酸素O2の質量[mg]である。
ある河川のCODを求めるため次の操作(1)から(4)を順次おこなった。
・・・かなり長文でヤヤコシイですね。
この様な複雑な問題は、とりあえず問題文を図に書き出してみましょう。

<CODの手順図>
KMnO4の役割として
①有機物を酸化 ②反応せず残る(残っているから赤紫色が残る)
$$その後、Na_{2}C_{2}O_{4}$$
を入れることによって②のKMnO4と酸化還元反応を起こさせます。(透明になる)
$$ただ、ここでもNa_{2}C_{2}O_{4}が残るので、$$
最後に操作(3)滴定によって完全に反応を完了させるといった流れになります。
また操作(4)のことをブランク実験と言います。
ブランク実験とは
ブランク実験とは、試料を分析するときに用いる試薬、容器、実験室などからの、不純物による誤差を補正するために、試料を用いないで同様の操作をすることです。
この問題においては操作(4)が非常に重要なポイントで、100mLの操作を行うと何かしらの器具か、なにかがKMnO4と反応するよ、ということを示しております。
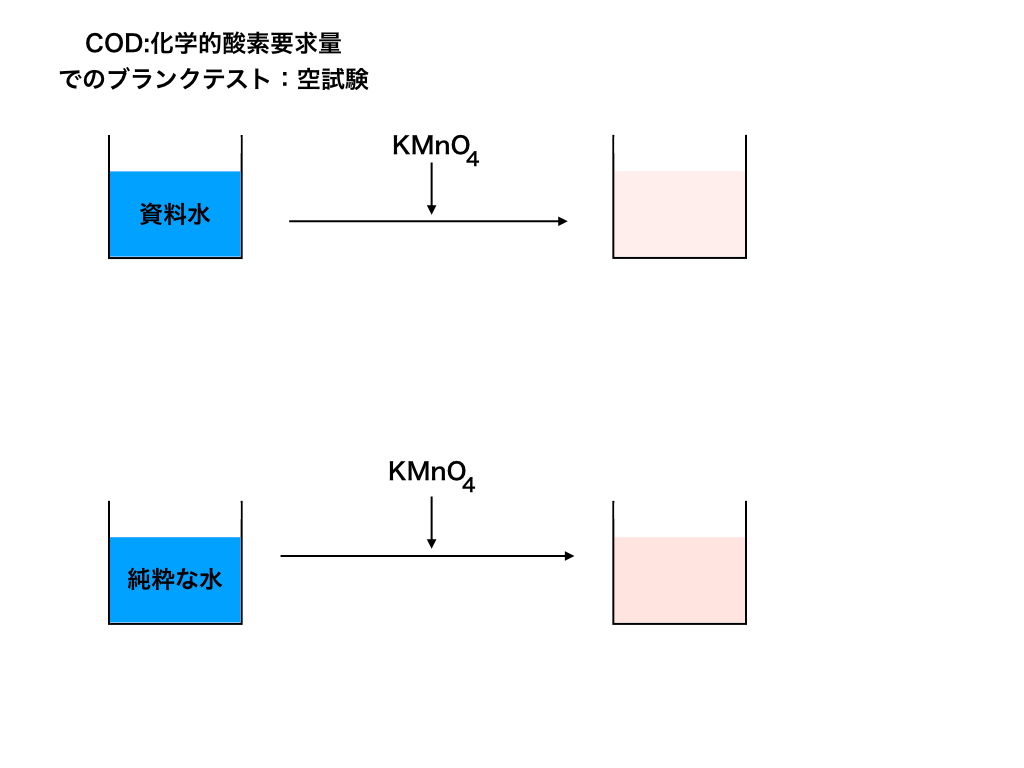
<ブランク実験イメージ図>
つまり、実験の目的とは違うものが反応しているということです。
この数値はどこかで差し引く必要があるので注意です。
以上がCODの具体的な手順になります。
化学的酸素要求量を実際に求める
試料水100mLの中の有機物と反応したKMnO4をα molとします。
有機物と反応後、残ったKMnO4が、
$$(5.0×10^{-3}× \frac{10}{1000} -α)mol$$
次に、KMnO4、Na2C2O4(C2O42-)の半反応式は、
$$(MnO_{4})^{-}+8H^{+}+5e^{-}→Mn^{2+}+4H_{2}O (5価)$$
$$(C_{2}O_{4})^{2-}→CO_{2}+2e^{-} (2価)$$
$$KMnO_{4}とNa_{2}C_{2}O_{4}((C_{2}O_{4})^{2-})$$
の酸化還元反応を考えると
$$操作4より、KMnO_{4} 0.59mL分はNa_{2}C_{2}O_{4}((C_{2}O_{4})^{2-})$$
とは未反応であることがわかる。
$$5× ((5.0×10^{-3}× \frac{10}{1000} - α)$$
$$+(5.0×10^{-3}×\frac{(2.09-0.59)}{1000}))
$$
$$=2×(1.25×10^{-2}×\frac{10}{1000})$$
$$→α=7.5×10^{-6} mol (100mLの試料水に対して)$$
CODは試料水1.0Lあたりの数値なので、
$$7.5×10^{-6}×10=7.5×10^{-5}( mol) 分反応する$$
$$ここで、KMnO_{4} :7.5×10^{-5}(mol)が酸化剤として$$
試料水中の有機物と反応するということは、7.5×10-5×5(mol)のe-を受け取るということになる!
自然界では、この分のe-をO2が受け取っているので、求めるCODは
$$(O_{2}+4H^{+}+4e^{-}→2H_{2}Oより4価の酸化剤)$$
$$(7.5×10^{-5}×5)×1/4×32×10^{3}=3.00(mg/L)$$
従って、答え:3.00(mg/L)となります。
化学的酸素要求量の実験問題まとめと酸化還元シリーズ一覧へ
<化学的酸素要求量の手順まとめ>
CODの手順1:サンプルに過剰なKMnO4を加える→
CODの手順2:今度は過剰な還元剤シュウ酸を加える→
CODの手順3:最後にもう一度KMnO4を加える。
CODの手順4:ブランクテストを行う
ここからは、1〜4の滴定の結果をもとにして酸素に換算する計算作業をしていきます。
→CODの手順5:O2に換算する
上の一連の流れを見たように、CODの問題は文章が非常に長く、実験も煩雑になります。
ですから、理解をするのは大変ですが、図を描きながら整理をして一つ一つ計算できる部分で電子のやり取りを数値化していきましょう。
あとはCODの定義に沿って数字を変換していけば、自ずと答えが出るようになっています。
きちんと復習と問題演習をすることで、自分のものにしましょう。
酸化還元反応シリーズ
第1回:「酸塩基反応と酸化還元反応の違いを答えられますか?」
第2回:「イオン化傾向と酸化還元反応(電池)」
第3回:「ダニエル電池の計算問題とファラデー定数」
第4回:「電気分解とは?電池との違いと陽極/陰極でのルール」
第5回:「イオン化傾向とイオン化エネルギーの違いとは?」
第6回:「酸化剤と還元剤を酸化数で見分ける方法」
第7回:「酸化還元反応とアルミニウムの融解塩電解」
第8回:「酸化還元滴定を初めから解説!半反応式の作り方から演習問題まで」
第9回:「リチウムイオン電池の仕組みを解説」
第10回:「」
第11回:今ここです「COD:化学的酸素要求量とは?その意味と手順・問題演習」
今回も最後までご覧いただき有難うございました。お役に立ちましたら、シェア&当サイト公式Twitterのフォローをお願いします!
質問・記事について・誤植等はコメント欄、その他のお問い合わせとご依頼はお問い合わせページまでお願い致します。

