有機化学反応を3種類に分けてみよう
今回は、ベンゼン環の正体(リンク)の記事の続きです。
もしまだ読んでいなければ是非読んでみて下さい。特にσ結合とπ結合は理解して下さい。
始めにこの記事の終わりまでキッチリ読んでもらえると、下3つが手に入ります。
⒈有機化学の反応がグループ分けできる様になります。
⒉理屈で覚えるので暗記の時間が短縮します!
⒊応用問題に太刀打ちできる基礎力が付きます!
さて、
有機化学反応は(特に高校分野では)、ただひたすら沢山の反応を覚えないと!と、
語呂合わせを必死にとなえたり、反応経路図を何度も何度も書いている人が多いです。
勿論、最低限の暗記は必要ですし、しっかりした理解の後に経路図を書く事は悪い事では無いです。
しかし理屈を考えず記憶に走ると応用がきかない上に時間がかかり百害あって一利なしです。
(この事はこのサイトのテーマでもあり、どの科目でも同じです。)
本題です。
有機化学反応は大きく3種類に分ける事ができます。
それは
「求核反応」
「求電子反応」
「ラジカル反応」
の3グループです。
「難しそう…と思わないで下さい!」
求とは求める事です(難しく無いでしょ?)
核は原子核の事をイメージしてみます。中性子と陽子がありますね?中性子は電荷が無いので陽子のプラスの電荷を持っている、つまり核はプラス
電子はそのままです。マイナスの電荷を持つ、
ラジカルは下でも解説しますが、共有結合の共有電子対を真っ二つにした状態と考えて下さい。
具体的なラジカルの作り方は、塩素分子に光照射したり、水素分子に吸着性のある触媒を与え、
水素分子の片方の原子を無理矢理引っ張る事でH•カケル2個にするといったものがあります。
例) Cl:Cl→Cl・と・Clに分かれた状態です。
この4つのコトバを組み合わせて反応を分類します。
求核反応
求核反応とは、陰イオン(ヒドロキシ基等)が反応する相手の陽性電荷(上で説明した核です)の部分にアタックしていく反応です。
求電子反応
求電子反応はその名の通り、陽イオン(Cl+やH+等)が反応相手のマイナス電荷(例:ベンゼン環の電子雲)にアタックする反応です。
ラジカル反応
ラジカル反応は不対電子を持ったラジカルという非常に不安定な物質(例:Cl•)が、
共有電子対を持った安定状態になる為に他の化合物の一部と合体する反応
と言えます。
英語にもradicalという単語が有ります=急進的なといった意味ですが、
確かに他の2つの反応と比べても急激かつ過激な反応を起こします。
大抵の有機反応はこの3つで説明する事ができます。
例えば、ベンゼン環はとても安定な物質なので、付加反応は起こりにくい、と習った人も居ると思います。
そんな中でもベンゼンの付加反応として教えられるのが、
ベンゼン+3H2→C6H12(シクロヘキサン)
ベンゼン+3Cl2→C6H6Cl6(ヘキサクロロシクロヘキサン)
の二つです。触媒や高温高圧or光照射下で反応する!と覚えてもいいのですが、それではせっかく反応を勉強した意味がありません。
これは典型的なラジカル反応です。水素ラジカルや塩素ラジカルがベンゼン環のπ電子雲に突っ込んでσ結合を結びます。
すると一気に安定していた共鳴状態が崩れて、残りのラジカル達が雨あられとπ結合を破壊し、全てσ結合にしてしまうのです。
実際シクロヘキサンやヘキサクロロシクロヘキサンの図を見てみて下さい。
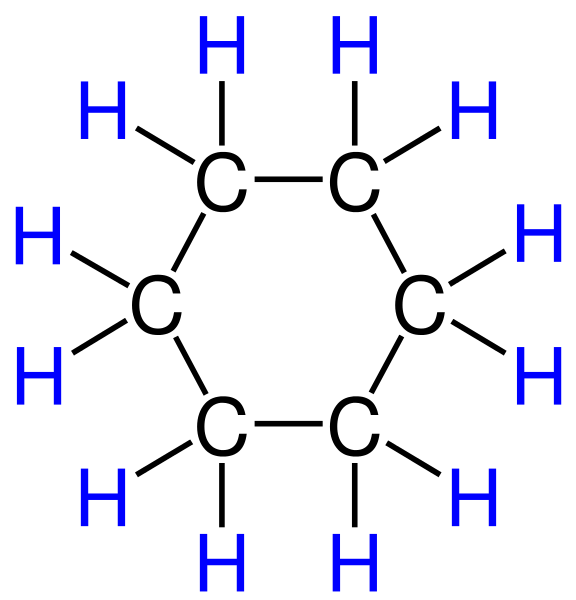
image by File:SikloHeksan 2 für Kurdi-Seite001.svg
全部単結合(=σ結合)になって居るでしょう?
こんな芸当が出来るのもラジカルだからです。
<中間まとめ>

image by File:Addition reactions general overview.svg
Author Dissolution
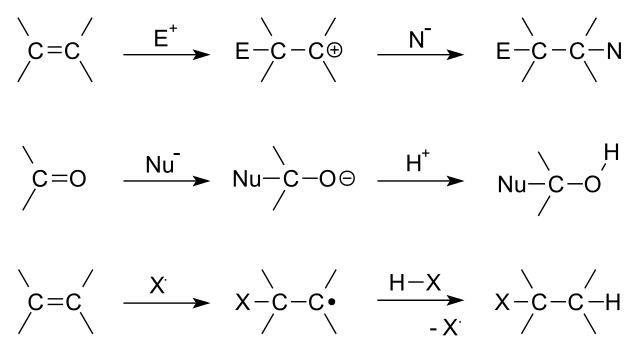
一番上が求電子反応(E+が左の炭素の電子と反応して、単結合を作りCーC間の電子が左に寄りCーCδ+となって、陰イオンN-とくっつく)
真ん中が求核反応(Nu-がCーCの左の核と反応し、単結合を作りCーC間の電子が右に寄りCーCδ-となって陽イオンH+とくっつく)
一番下がラジカル反応(ラジカルXがCーCの左を攻撃してCーCの右炭素と水素がくっつく)
他2つの反応と分類についてはまた記事を書きますが、少しだけ予告しておくと、
求電子反応グループは(ニトロ化、スルホン化、…)
求核反応グループは(エステル化、加水分解、アミド生成反応…)
とまとめてしまうことが出来、同一グループの反応の順番や、理屈はほぼ同じなので、
最終的にグループさえ覚えていれば各々の反応の詳細は自然に頭に浮かぶ様になります。
有機化学で使う試薬の反応(ニンヒドリン反応、キサントプロテイン反応、他)を実際にこの記事の反応を元に説明した記事を作成したので
ぜひご覧ください。↓
有機反応を制する者は有機化学を制し、化学が得点源になる。余った時間で他科目に時間を回せるので、合格にかなり近づく。
オマケとして大学入学後の講義にもスムーズに接続できるようになります。(特に化学科や医学科、薬学部)
その為にも少し大変ですが少しずつ理解していきましょう。リクエストや質問はコメントまで。