
イオン化傾向と酸化還元反応
酸化還元の分野に入った時、いやでも覚えさせられるのがこのイオン化傾向ではないでしょうか?
沢山の元素が並んでいて、大変だとおもっている人もいるでしょう。
しかし、イオン化傾向は一度理解して身に付ければ、理論化学はもちろん、暗記分野と思われている「無機化学」でさえ理屈で考える事ができるようになり、大幅に暗記量を減らす事ができるのです。
今回から数回に分けて、イオン化傾向とその周辺(酸化還元反応、電池、電気分解)等々を解説します。
まとめページ出来ました!→「酸化還元反応の分野別記事総まとめ」<<
化学は理解する科目です。是非イオン化傾向をマスターして理論/無機化学を有利に進めましょう!
目次(タップした所へ飛びます)
イオン化傾向とは
まずはじめにざっくりとイオン化傾向とは何かを説明していきます。(高校範囲、大学入試の範囲での説明です)
イオン化傾向とは、「(主に金属元素の中で)イオンになりたい!」という気持ちが強烈な元素を左端へ、
「イオンに別になりたいわけでは無い」元素を右端へ配置して、
その間に「イオン化したい!」気持ちが強い元素順に左から並べたものです。
実際に見て見ましょう。
イオン化傾向の覚え方(語呂)
k、Ca、Na、Mg、Al、Zn、Fe、Ni、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
「か(カリウム)、そうか(カルシウム)、な(ナトリウム)、ま(マグネシウム)、あ(アルミニウム)、あ(亜鉛)、て(鉄)、に(ニッケル)、すん(スズ)、な(鉛)、(ひ)、ど(銅)、す(水銀)、ぎる(銀)、しゃっ(白金)、きん(金)」
(アルミニウムAl、亜鉛Zn、の「あ、あ」のところや、水銀Hg、銀Agの「す、ぎる」のあたりは順序を逆に覚えてしまったり、一つ元素を飛ばしてしまう事がたまにあるので、要注意です!)
人によって覚え方は異なるので、自分に合ったものを使って下さい。
慣れてくれば、語呂に頼らなくとも自然に覚えてしまいます。
イオン化傾向と酸化還元反応(1)電池
イオン化傾向とはイオンになりたい気持ち順に元素を左から並べたものだと説明しました。
金属元素には当然電子e−が存在するので、金属元素が陽イオンになれば同時に電子も放出されます。
M→M2+ +2e− (MはMetalの意味でよく使われます。)
電子を放出する元素があれば電子を受け取る元素も有るはずです。
この『電子の授受』が起きる反応のことを酸化還元反応と言いました。
【参考:酸化還元反応と酸塩基反応の違いを1行で答えられますか?】
この「電子の授受」を利用した装置があります。それが電池です。
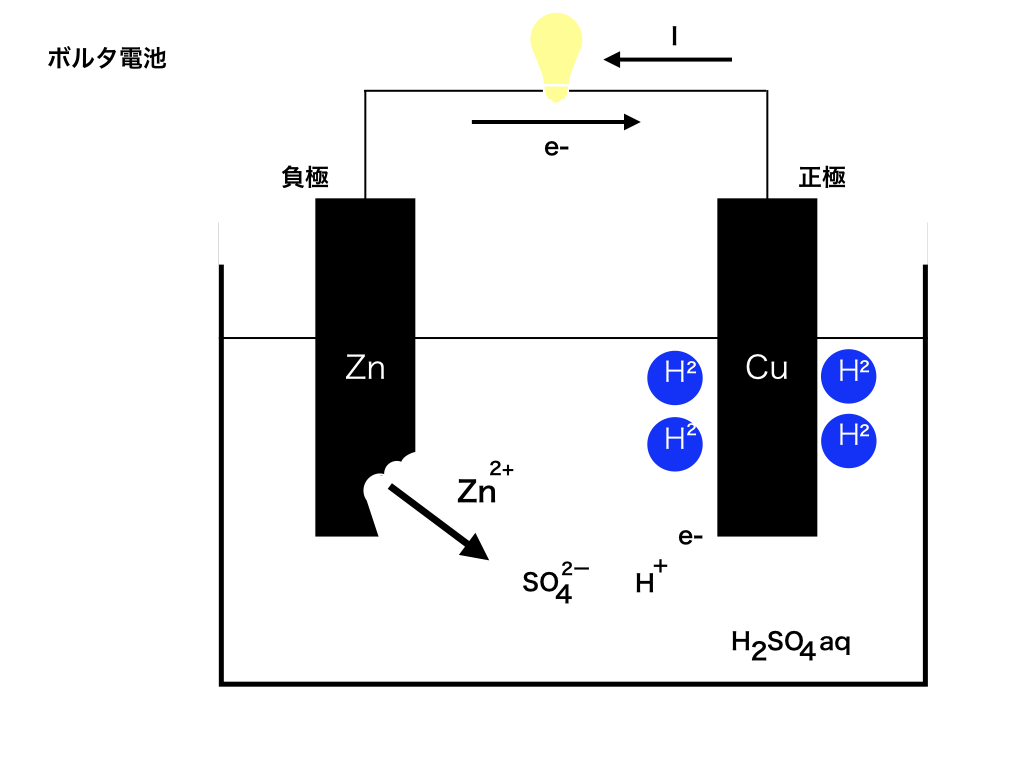
ボルタ電池
電圧の単位Vボルトにその名をのこした、イタリアのボルタによる初めての電池です。
仕組みは次の通りです:まず銅(Cu)と亜鉛(Zn)の板を電解液(電気を通す溶液のことです。ボルタ電池では硫酸)に入れ上部を電線でつなぎます。
イオン化傾向を見ると、
(大)k>Ca>Na>Mg>Al>Zn>Fe>Ni>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au(小)
と、圧倒的に亜鉛の方がイオンになりたい気持ちが強いです。
そこで、Zn→Zn2++2e- と亜鉛は陽イオンに変化し、同時に放出された電子は上部の電線を通って、別にイオン化したくない銅板へ流れます。
電子の流れと電流の流れの向きは反対なので、注意して下さい。
電子はZn→Cu方向へ、電流IはCu→Zn方向へ流れ、正極が銅Cu負極が亜鉛Znになります。
電子が流れるということは電流が流れるので、電線に電球をつけたりすれば光ります。
これがボルタ電池の仕組みです。
ちなみに、e-を受け取った銅板は、そのまま電子を電解液中のH+に渡します。
すると、2H++2e-→H2 水素が発生します、この水素が銅板を取り囲むせいで
電池がすぐに使えなくなってしまいます。これを「分極」と言います。
<図1>
<図1>
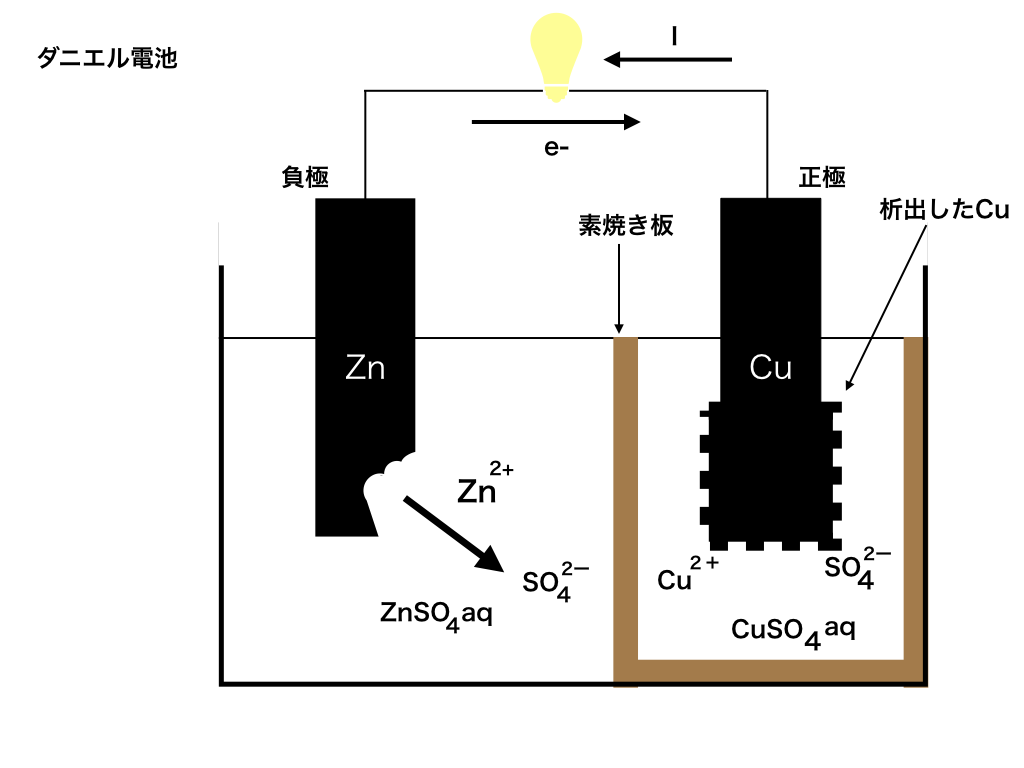
ダニエル電池
ボルタ電池は、上記のように銅板が水素に覆われて直ぐに使い物になら無くなってしまいました。
そこで、ボルタ電池の極板はそのままに、ある工夫をしてその問題を解決した人物が現れました。
イギリスのダニエルは、ボルタ電池の極板間に素焼き板を設置し、
電解液をH2SO4aqから、Zn極側はZnSO4aqに、Cu側はCuSO4aqに変える事で
この分極を防ぐことに成功しました。(”aq”は”aqua”という意味で大量の水を意味します。)
素焼き板と呼ばれるもので仕切った電池は下の<図2>のような構造をしています。
構造と素焼き板の役割
さて、正極の銅板には電子が電線を通って来ます。ボルタ電池では、電解液中のH+に電子を渡して水素が発生しました。
一方このダニエル電池では電線から受け取った電子と、電解液であるCuSO4aqからCu2+を得て銅が析出(簡単に言うと銅板に銅がまとわりつくようなこと)します。Cu2+ +2e- →Cu
銅板の表面に更に銅がくっついても、質量が増えるだけで分極しないので、この工夫によってボルタ電池の欠点を克服したわけです。
ここで、電解液のCuSO4の内SO42-は特に反応しません。
同様に、負極側では電子を放出したZn板から溶け出したZn2+も反応しません。
このままでは、正極側にSO42-がたまっていき、負極側でZn2+がたまっていく為に正極側と負極側で±が偏ってしまいます。
ここで役立つのが素焼き板です。
素焼き板は、2つの電解液(硫酸銅aqと硫酸亜鉛aq)が混ざることを防ぐとともに、
Zn2+やSO42-などのイオンが自由に移動できるようにする役割を果たします。
それによって、正負の電荷を持ったイオンが一方に溜まっていくことを防ぐことができます。
<図2>
まとめと次回予告
・イオン化傾向とは、イオンになりやすい(金属)元素を左から並べたもの。
・イオン化傾向の異なる金属同士をつなぎ、回路を作ると電子の授受が起こる
・ボルタ電池は正極が水素に覆われ分極するという欠点がある
・ダニエル電池は、ボルタ電池の極板間に素焼き板を設置し、電解液を変えることで分極しない電池になった。
酸化・還元反応の続編+まとめページへ
「酸化還元反応の解説記事のまとめページ」←を作成しました!
次回は、ボルタ電池やダニエル電池の知識を使って、計算問題を解いていきます。さらに、その他のメジャーな電池についても紹介します。
>>「リチウムイオン電池の仕組みと歴史」を読む
第2回:「イオン化傾向と酸化還元反応(2)ダニエル電池とファラデー定数」を続けて読む。
第3回:「電気分解とは?電池との違いとルールをイオン化傾向を使って解説」を読む。
第四回:「イオン化傾向とイオン化エネルギーの違いとは」を読む。
今回も最後までご覧いただき有難うございました。
お役に立ちましたら、シェアをお願いします!
質問・記事について・誤植・その他のお問い合わせはコメント欄までお願い致します。

