硫酸の性質と接触法(無機・理論化学)
この記事では、硫酸(濃硫酸・熱濃硫酸・希硫酸)と硫黄化物の性質・工業的製法(接触法)について、それぞれ頭に入れておくべきことをまとめています。
目次(タップした所へ飛びます)
硫酸の製法(接触法の流れ)
まずは、「硝酸の工業的製法(オストワルト法)」に続いて、代表的な強酸である”硫酸”の工業的製法を紹介していきます。
接触法の手順と触媒
5酸化2バナジウム\(\mathrm{V_{2}O_{5}}\)を触媒として、硫黄(あるいは、Sを含む\(\mathrm{FeS_{2}}\):黄鉄鉱)から、次のような段階を踏んで硫酸を製造します。
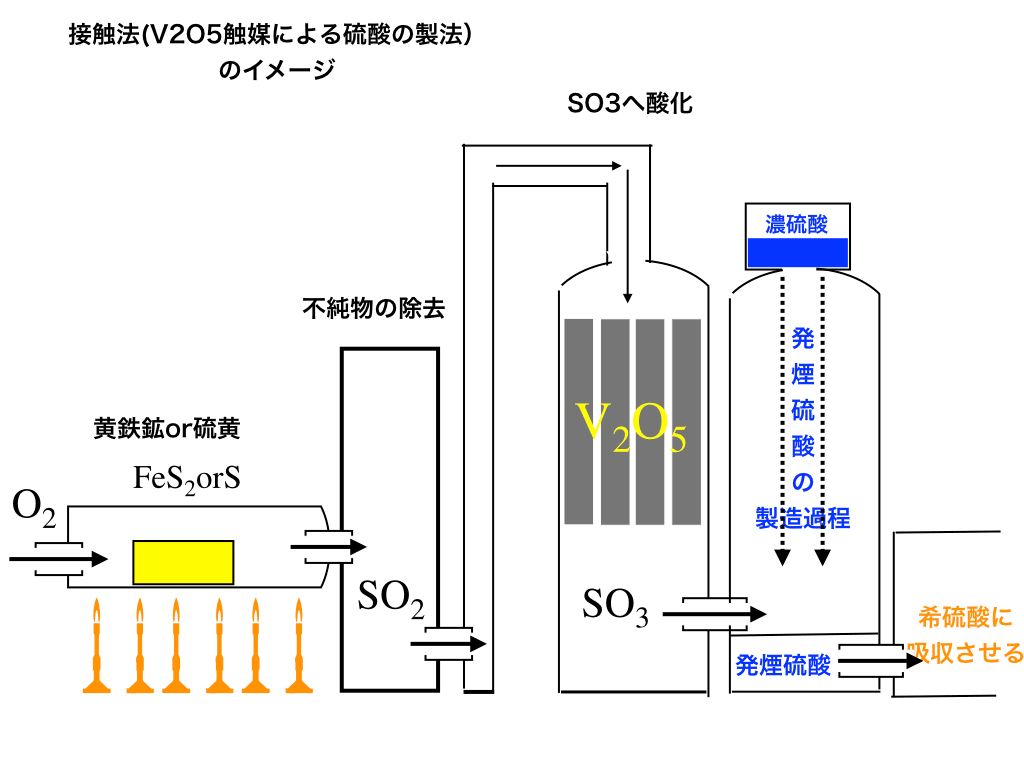
<接触法のイメージ>
1:硫黄を二酸化硫黄へ
第一歩目となるのは、硫黄から二酸化硫黄にする(燃焼させながら空気を加え、酸化させる)ことです。
\(\mathrm{S\rightarrow SO_{2}}\)
この段階では出来上がった二酸化硫黄に不純物が混じっているので、途中で除去し(これは次の触媒を守るためでもあります)5酸化2バナジウムが設置してあるところへ進みます。
2:二酸化硫黄を三酸化硫黄へ
1で製造した二酸化硫黄を装置の上から空気(酸素)とともに触媒を通過させて、
\(\mathrm{SO_{2}\rightarrow SO_{3}}\)三酸化硫黄に変化させます。
3:三酸化硫黄を発煙硫酸へ
更に、三酸化硫黄も(のちに解説する『水和熱が非常に高い』という性質**を硫酸と同じく持っているので、直接水を加えると危険)濃硫酸に一旦吸収させて、発煙硫酸と呼ばれる物質を作り出します。
\(\mathrm{SO_{3}+H_{2}SO_{4}\rightarrow 発煙硫酸}\)
発煙硫酸とは
硫酸と三酸化硫黄の混合物を『発煙硫酸』と呼びます。その名の通り水などに通すと、煙のように硫酸が発生するものです。
発煙硫酸を希硫酸へ
最後に発煙硫酸を希硫酸に吸収させて(これも発煙硫酸の時と同様に、硫酸をいきなり水で薄める訳にいかないので**希釈に希硫酸を用います)これによって、接触法の一連の流れは終了です。
硫酸/硫黄化物の性質
ではここから、接触法によって出来た硫酸や硫黄化物の特徴や性質・覚えておくことをまとめていきます。
濃硫酸と希硫酸
”硫酸”は濃度や温度によって、さまざまな性質の違いがあります。
熱濃硫酸の性質
熱濃硫酸は酸化力が強い、という点
→普通の硫酸では溶かすことができない、「イオン化列」の小さいものを溶解(参加させることができる)。
(例);熱濃硫酸はPtの一歩手前である、Agまで溶かすことが可能です。
濃硫酸の性質
・脱水作用
→最も代表的なのは、スクロース(ショ糖)をはじめとする有機化合物などを炭化させる(スクロース中の-OH基から\(\mathrm{H_{2}O}\)を取り出す、他にも、フタル酸やエタノールなどの分子間・分子内脱水を行う際に用いられる。等々、、、)作用です。
・不揮発性
→濃硫酸はドロドロ(粘度が高い)ので、揮発しにくいことからその性質を応用して揮発性の酸を作る時に役立ちます。
・吸湿性
→作成した気体から水分を吸収するなどの、乾燥剤として利用します。
濃硫酸を希釈(薄める方法)【超頻出】
濃硫酸から希硫酸をつくる=薄める(希釈する)時の操作については、その方法を理由とともに理解し、いつでも答える事ができる様にしておく必要があります。
方法:多量の水をかき混ぜながら、そこに濃硫酸を少しずつ加える。
<理由>:硫酸と水和熱**
→硫酸は水和熱がとても大きい(**)ので、硫酸に水を加えていくとその水が一瞬で沸騰し、硫酸とともに周りに飛び出します。
→これでは非常に危険なので、多量の水に硫酸を加えることで急激に温度を上昇させず、徐々に濃度を薄める事が可能になります。
希硫酸の性質
希硫酸の性質としては、ここまで紹介してきた熱濃硫酸・濃硫酸と同じく『強酸性』があります。(他の3つの性質は希硫酸には存在しません)
脱水・不揮発性・吸湿性を持つ理由
ではなぜ硫酸(濃硫酸)は上のような性質を持つのか、それを以下の電子式を見ながら解説します。
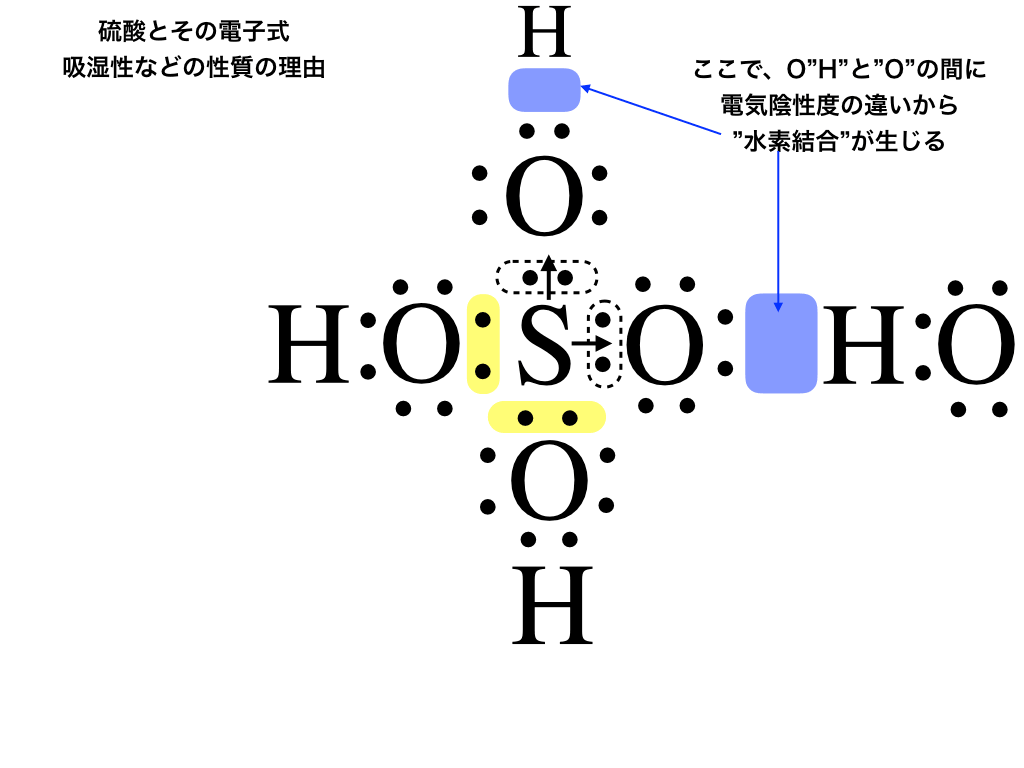
<\(\mathrm{H_{2}SO_{4}}\):硫酸の電子式と水素結合>
上の図のように、硫酸はS原子にーOHが二つ、→Oが2つくっ付いたような形をしています。
参照:「配位結合とは」
ここで、H水素とO酸素はそれぞれ電気陰性度の差がとても大きい為に、お互いにδ+、δーの電荷の偏りが生じて引き合います(=水素結合)。
この性質によって、スクロース中のヒドロキシ基を脱水したり、気体中の水分を水素結合で引っ張ることで吸湿性を持つのです。
硫黄化物と硫黄の性質(追記中)
「同位体と同素体」で、硫黄について解説しています。二酸化硫黄、三酸化硫黄などについては現在作成中です。
硫酸と硫黄化物まとめ
このように、接触法自体はそれほど複雑ではない(あくまで他のアンモニアソーダ法などと比べれば)です。
が、そこでの生成物である\(\mathrm{H_{2}SO_{4}}\)や、二酸化硫黄などは様々な特徴を持っており、それらの性質の理由は(途中『水素結合』を用いて解説したように)理論分野と融合して良く問われます。
それぞれの範囲をしっかりと整理して復習しておきましょう。
無機・工業的製法へ
最後までご覧いただき、誠に有難うございました。
・お問い合わせ、ご依頼等のご連絡は、ページ上部の【運営元ページ】よりお願いいたします。

