フェノールの製法とベンゼンの正体
**この記事はベンゼン環の正体の記事をもとに執筆しています。
もしまだ読んでいない方はベンゼン環の正体と結合を先に読んで頂くと理解がスムーズに進むと思います**
目次(タップした所へ飛びます)
さて、今回はフェノールの製法の本当の反応と触媒の実際の役割について解説します
ベンゼン環は図1の様な形で負の電子雲にサンドイッチされていました。
これこそがベンゼン→フェノールの製法を難しくしている
(ベンゼン環の上下の電子雲と、ヒドロキシ基の負電荷が反発し合う為に直に接続出来ない)理由です。
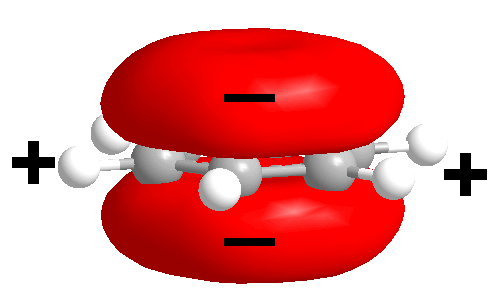
図1
では、どうしたらフェノールを作れるのでしょう。
大学受験に於いて知っておくべき製法は基本的に3つ、即ち[ベンゼンスルホン酸経由かクロロベンゼン経由]/[若しくはクメン法]です。
2グループに分けた理由
それは後者のクメン法は前者の2製法に比べて反応が少し異なり複雑な為です。
(クメン法の詳細な反応の記事については、追ってアップする予定です。)
グループ1[ベンゼンスルホン酸経由&クロロベンゼン経由]
発想を逆転させます。 マイナス電荷だと跳ねられるのなら、一旦プラス電荷を突撃させれば良いのです!
そしてσ結合させた後、突撃させた元プラス電荷物質をヒドロキシ基で置換します。
順序は以下の通りです。
プラス電荷を持つ物は当然ベンゼン環へ近づいていきます。そして、六角形のベンゼン環のうちの一つの炭素と結合させます。
この時、ぶつけるプラス電荷物質は電気陰性度が高いものが良いです。
**電気陰性度は電気陰性度は高校化学最重要の概念です!で詳説しています。
有機反応の理解に必須なので未読の方はこちらも読んで下さい。**
何故なら、ベンゼンと結合した時、プラス電荷物質の方に炭素との共有電子対を引っ張ってくれるので、
(これを電子吸引性が大きいと言います)元プラス電荷物質を置換する際、炭素の電子もろとも何処かへ飛んで行ってくれます。
するとベンゼン環の元結合炭素は電子を失いδ +の電荷を帯びます!ここでようやく、
マイナス電荷物質のヒドロキシ基(OH-)がくっつく事ができます。
グループ1でぶつける物質はClとSO3Hです。(クロロ化とスルホン化です)
しかし、ここで疑問が出てきませんか?
Cl-もSO3H-も元々はCl2 or H2SO4だったわけで、Cl原子もH2SO4からH +を引いたSO3Hもマイナス電荷です!!
このままではまたしても電子雲に阻まれてベンゼン環に近付けません……
そこで、触媒が役に立つのです。
クロロベンゼン経由時には触媒として、FeCl3を使います。鉄Feは4配位の錯イオンになりたいという性質があります。
つまりもう一つClが有れば、[FeCl4]-に成れる。そこに丁度Cl2が居るわけです。鉄はCl-を引き抜いて錯イオンになります。
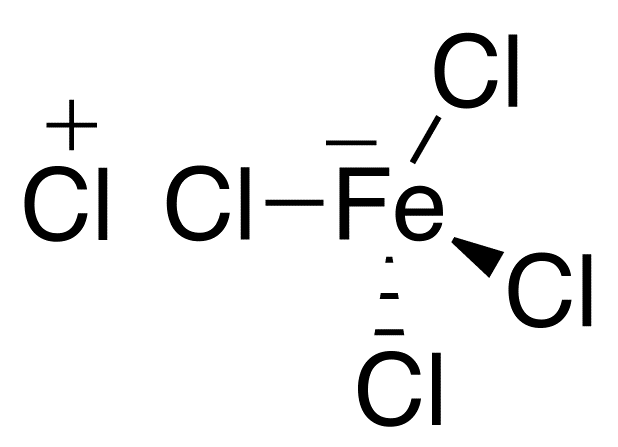
同時に共有電子対ごとClを引き抜かれたもう一方のClは陽イオンになります。
Cl2→Cl- + Cl+
そして心置き無く塩素イオン(+)はベンゼン環の一つのCーH結合に突撃し、CーCl結合となります。クロロベンゼンの完成です。
電気陰性度の差からCーCl間ではClが共有電子対を引っ張り、そこにNaOHが攻撃した際にCの持っていた電子ごと飛んでいきます。
**だから電子吸引性の高いClやSO3Hでないといけないのです。**
つまりベンゼン環の一つのCが電子不足になり、そこにーOHが求核反応を起こしてくっ付き、フェノールが出来上がる。という流れです。
次にベンゼンスルホン酸経由について。
基本的な反応の考え方は上のクロロベンゼン経由と同じです。
違いはベンゼンスルホン酸を作る時に、SO3Hがマイナス電荷なので、プラス電荷物質にする為に使う触媒が濃硫酸である事位です。
具体的には、濃硫酸H2SO4(触媒)とベンゼンと硫酸(触媒でない)を用意して、濃硫酸がH +を硫酸へ突撃させます。
その際、硫酸のOの非共有電子対とH +が結びつき、硫酸の中にH2Oが生じて脱離します。(いわゆる「脱水」反応です)
そうして(硫酸H2SO4)足す( H +)引く(H2O)=(SO3H +)となり、やっと正電荷を持つSO3H +が出来、
これがベンゼン環の炭素を攻撃して置換されてベンゼンスルホン酸が生成されます。
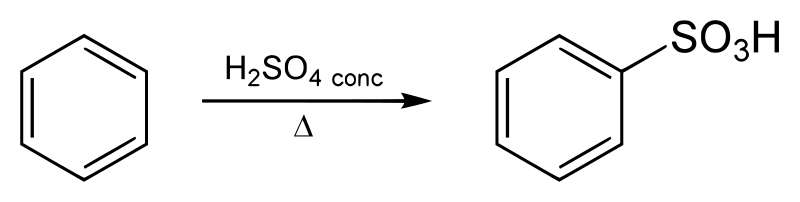
ここからはクロロベンゼン経由法と同じ流れです。Sが結合しているCから電子対を吸引し、
Cが電子不足となりこれをOH-が攻撃してフェノールが生成されます。
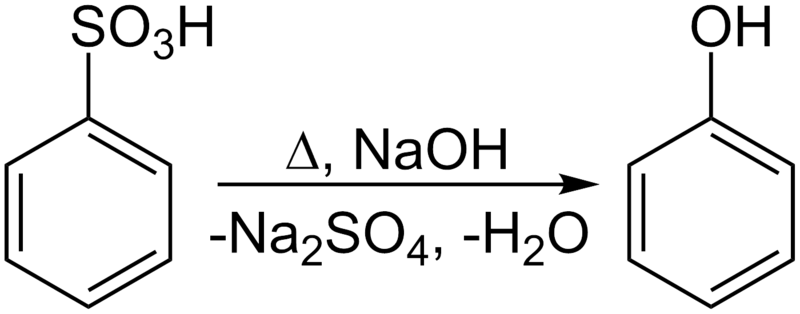
実際には、ーOHを直で置換せず、ーONaと置換してナトリウムフェノキシドにした後、
弱酸遊離反応を用いて、弱酸性のフェノールを遊離させます。
この辺りの解説は手元の参考書等にもありますので省略します。
本質的に重要なーONa置換以前の反応を詳しく説明せず、触媒もただ覚えろ!という教え方や本が一般的ですが、
せっかくこのサイトで勉強して頂いているので、求核反応、触媒の意味を分かってもらった上で覚えて欲しく記事にしました。
クメン法については追ってアップします。
※重要な補足:今日学習したクロロベンゼン及びベンゼンスルホン酸の生成反応は「芳香族球電子置換反応」と言い、同じ括りの反応として、
ブロモベンゼン生成反応/
ニトロベンゼン生成反応/
ジアゾカップリング反応等が有ります。
反応機序が同じなので覚えておいて下さい。
お疲れ様でした。
記事の質問、リクエスト、等がございましたら、コメント欄にお願いします。
又、お役に立ちましたら、SNSボタンをクリックしてシェアして頂ければ嬉しいです!

