化学結合の正体〜電気陰性度で考える〜
この記事では、化学結合の中でも分子内結合である金属結合、イオン結合と共有結合の違いと共通点について解説します。
目次(タップした所へ飛びます)
共有結合が金属/イオン結合の正体だ!
実は結合には大きく分けて2つ有り、
分子間結合と分子内結合
に分けることが出来ます。
原子と原子が結合する分子内結合と、分子と分子が結合する分子間結合(水素結合等)があります。
今日学習するのは分子内結合で、一般に学校では金属結合、イオン結合、共有結合の3つが主に教えられます。
そして以下の様な説明がされると思います
これら3つの結合の違いは、媒介する物が
金属結合:自由電子
共有結合:電子対の共有
イオン結合:クーロン力
という違いがあり、性質は金属結合が・・・
今回は、この様な一般的な説明ではなく少し違った角度から化学結合を解説したいと思います。
共有結合と電気陰性度
結論から言います。この3つの化学結合は同一と見なせます。
(少なくとも高校化学のレベルでは)結果的に学校で教えられた様な状態になるだけです。
そしてその理由は電気陰性度が教えてくれるのです。
*注*もし前回の記事を読んでいない人は一旦電気陰性度は高校化学の最重要事項ですに目を通しておいて下さい。

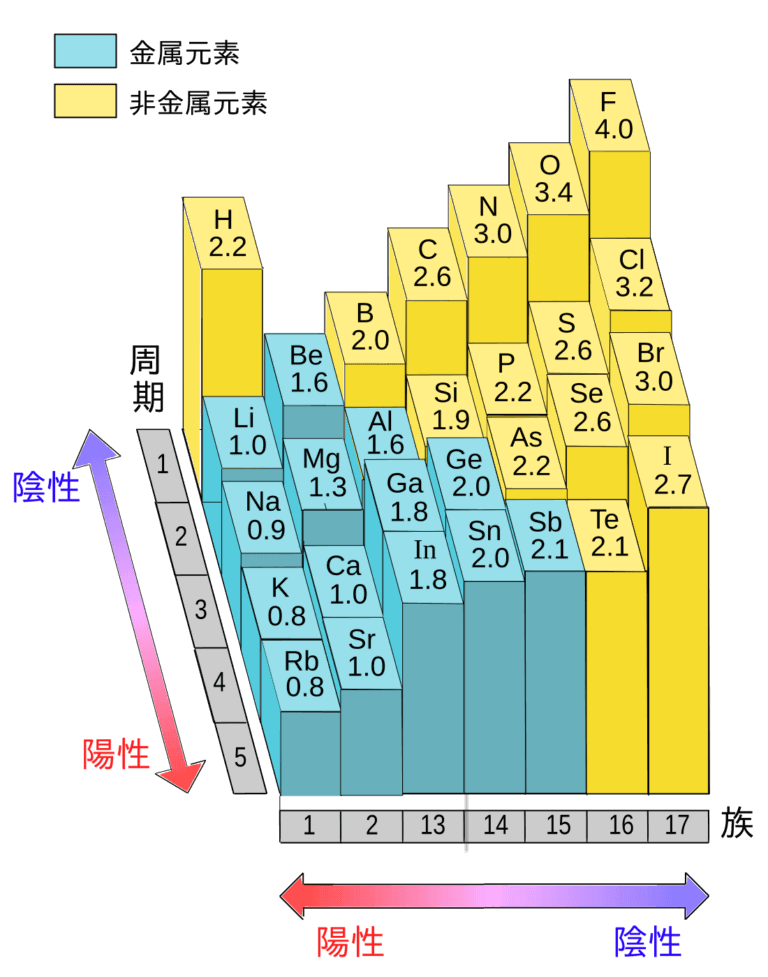 上の画像の様に周期表の右上へ行けば行くほど電気陰性度は大きくなります。
上の画像の様に周期表の右上へ行けば行くほど電気陰性度は大きくなります。
当然原子の種類の数だけ電気陰性度の数値は異なります。
共有結合が出発点
電気陰性度が異なる原子が共有結合をしようと、共有電子対をもつとき、
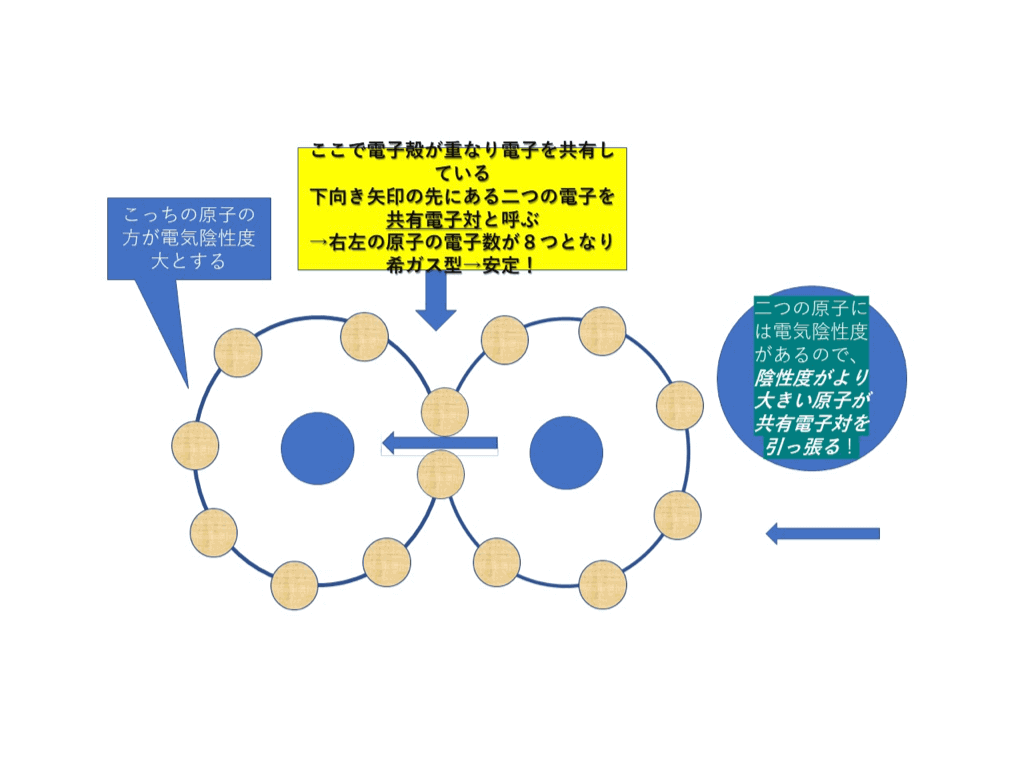
<図2>
<図2>の様に、
電気陰性度=電子大好き度が大きい原子へと共有電子対が引っ張られます。
結果的に、電子はマイナスの電荷を持っているので、電気陰性度が大きい原子の方へマイナス電荷がかたよります。
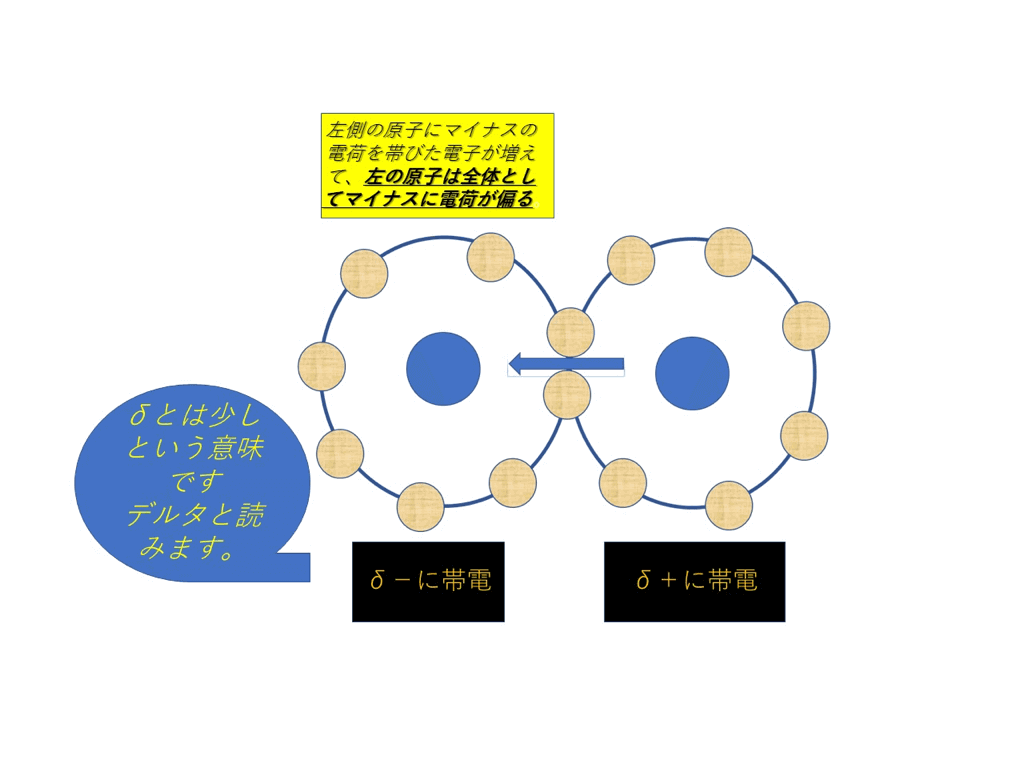
<図3>
そして<図3>の通り、プラス電荷とマイナス電荷を帯びた原子が出来ます。
では、この差が「少し」どころではなくとても大きい差のある原子同士が結合しようとするとどうなるでしょうか。
イオン結合と電気陰性度の差
上の問いに答えるために、仮に周期表の左下の方のフランシウムFr君とフッ素F君を近づけてみましょう。
周期表の図を見て下さい。この二つの原子君の電気陰性度の差は極めて大きいです。
するとフッ素君が共有電子対を物凄い強さで引っ張ります。そして、遂には電子を奪う様になります。
すると共有電子を奪われたFr君は電子が一個減りFr +に、フッ素君は電子を得てF -になります。
そしてプラスとマイナスは引き合い、、、結合します。コレがイオン結合の正体です。
金属結合と電気陰性度
電気陰性度は共有電子対を引っ張る強さでした。言わば電子大好き度です!
コレが小さいという事は余り電子は欲しくない、むしろ嫌いなのです。
そんな原子同士ではお互いに共有電子など要らないので押し付け合います。
電子嫌い原子君たちが集まって電子はあっちへこっちへいく先々で嫌われる羽目に合います。
仕方がないので電子はうろつき回ります。これこそ自由電子の正体です!そしてこの自由電子がうごく事によって、導電性を持ちます。
という事はこれがいわゆる金属結合です!
まとめ:化学結合は電気陰性度の数値の差で考えよう
・イオン結合 :構成する原子の電気陰性度が
大きいもの+小さいもの
値の差が大きい!
・共有結合 :構成する原子の電気陰性度が
普通の原子+普通の原子
普通=中くらいの数値
・金属結合 :構成する原子の電気陰性度が
小さい原子+小さい原子
いかがでしたか?
いかに電気陰性度が重要か少しはわかって頂けたのではないでしょうか。
これからどんどん電気陰性度をkeyに化学を解説していきます。
前の記事「電気陰性度と電子親和力、イオン化エネルギーの違い」を読む
電気陰性度を使って、有機化学反応を解説している記事を追加しました。以下よりご覧ください!
今回も最後までご覧いただき有難うございました。
質問・記事について・誤植・その他のお問い合わせはコメント欄までお願い致します!