
過不足のある化学反応(基本と前/中/後の図/表)
<この記事の内容>:『化学反応の結果、反応物のいずれかが余る/不足する』といった、いわゆる【過不足】に関係する問題の解き方を紹介していきます。
目次(タップした所へ飛びます)
化学反応式の過不足問題の目印と必ず描く"図(表)"
今回扱う反応物(化学反応式の左側)が完全に反応しきれない(つまり余る物質が出てくる)問題は、何から手をつけて良いのか分からなくなりがちです。
ここでは、まず化学反応式を作り(係数を合わせて)→過不足問題を解くコツである図(表)を書く方法を紹介します。
理解出来たら、次の定着用の演習問題を自力で解いてみてください。
(molの復習も載せているので、適宜ご利用ください)
反応式を作る
この反応は燃焼反応なので、二酸化炭素と水が生成されます。
C3H8+O2→CO2+H2O・・・(※)
(※)の式の係数は、目算法か「未定係数法」で決定します。
(係数を求めることが苦手な方は、→「化学反応式の係数を100%確実に求める【未定係数法】」を先にご覧ください。)
すると、(※)はC3H8+5O2→3CO2+4H2O・・・(※’)
となります。
反応式の下に「反応前」「中」「反応後」の図を書く【最重要】
係数を合わせて反応式が完成したら、過不足のある化学反応の問題を解くにあたって最も重要な【反応前/中/後の図表】を作ります。
具体的に一つ一つ紹介するので、ぜひ習得してください!
反応前の表の書き方
まず一番上に反応式を書き、以下の<図1>のように反応前・中・後の3段を作ります。
反応前の段に、問題文で与えられた質量と原子量からmol数を計算し、反応物(式の左側)にそれぞれ記入します。
この時、まだ反応は起こっていないので生成物(式の右側)には0と記入します。

<図1:反応前>
これで1段目が埋まりました。
反応中の表の書き方
次に、反応物のうちどちらが余るのか、物質量(mol)と反応式の係数比に注目して考えます。
ここでプロパンが全て反応したと仮定すると、プロパンの係数:酸素の係数=1:5なので酸素が2×5=10mol必要です。
しかし実際には1mol分しか酸素は存在しないため、この過程は誤りで『酸素の方が全て反応し、プロパンが余る』ことがわかります。
以上のことを踏まえると、
先ほどと同様に係数比とmol比の関係より、プロパンは1×1/5=1/5(mol)消費されることが計算できます。
・次に、この結果に基づいて減少するプロパンと酸素のmol数を”反応中の段”の反応物側にー◯mol(図中の青色の文字の部分)、
・新たに生成される二酸化炭素と水についても、それぞれ係数比にあわせて +△mol(赤色の文字で書いた部分)を記載します。
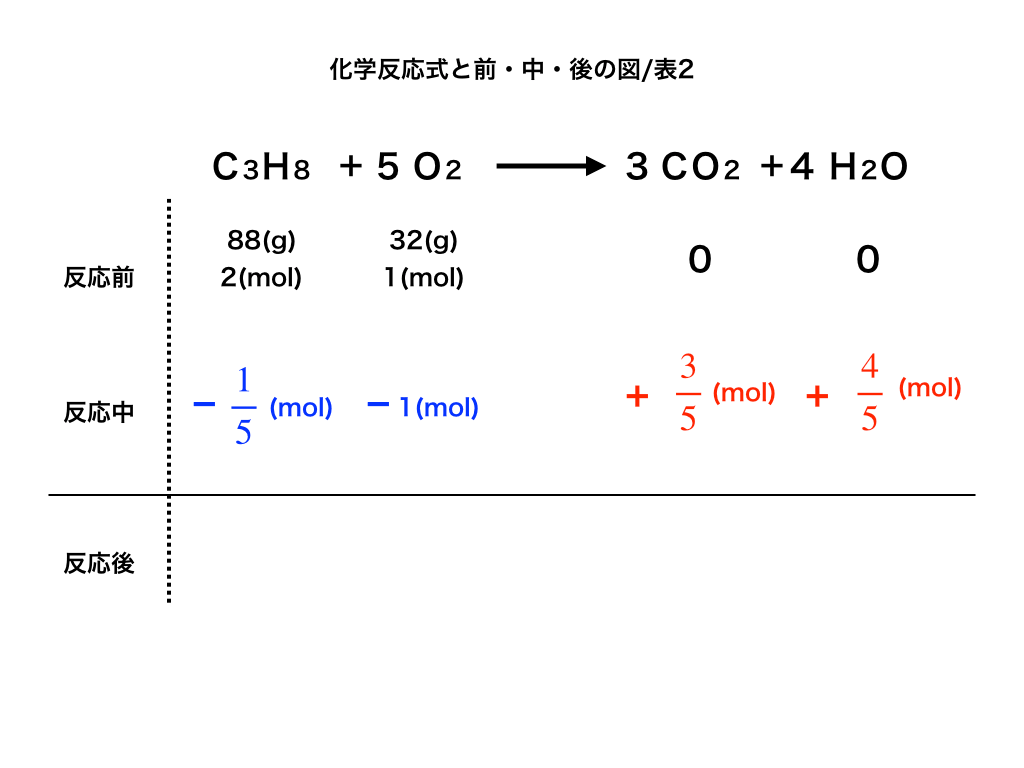
<図2前→中>
反応後の表の書き方
ここまで来れば残りは1段目(反応前) +2段目を計算し、3段目の反応後のところに書きます。
以下の<図3>のようにプロパンが 9/5molあまり、二酸化炭素は3/5mol・水は4/5mol生成されます。
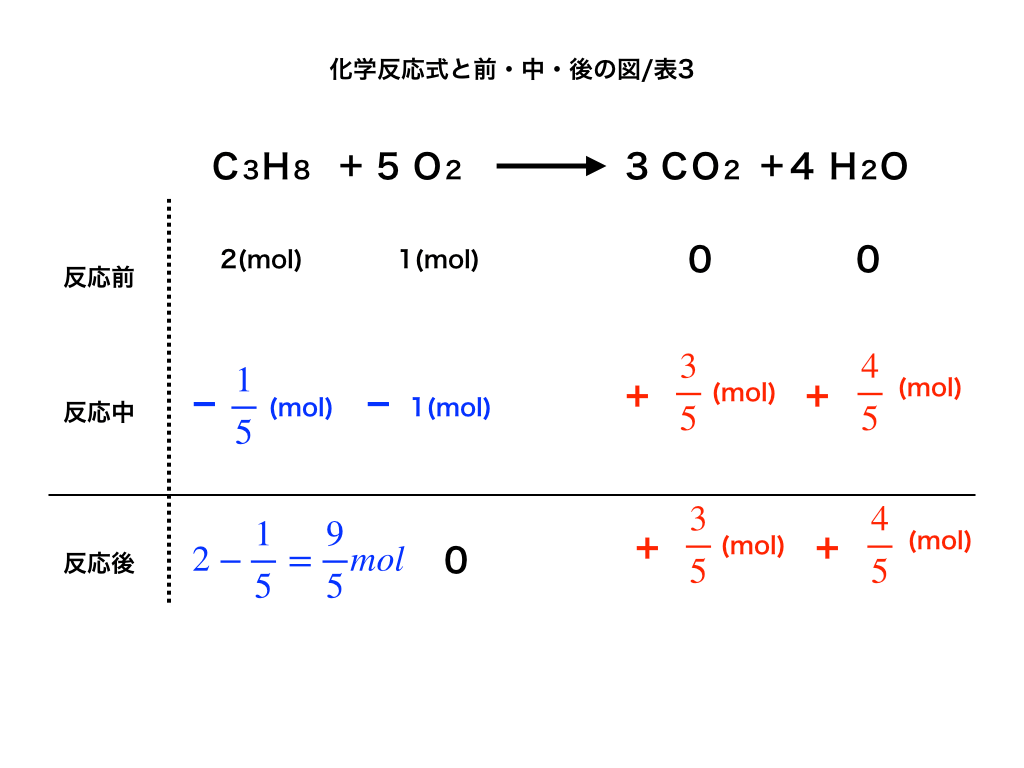
<図3:反応後>
単位を変換して答えを出す
問われているのは「質量」だったので、mol×分子量を各々計算すると、
生成された二酸化炭素は3/5(mol)・44(g/mol)=26.4(g)、水は4/5(mol)・18(g/mol)=14.4(g)
過不足ある化学反応の練習問題(基礎)
ここでは、化学反応の練習問題のレベルを基本的なものにとどめています。
しかし、ここで過不足のある問題の解法を習得すれば、さらに応用が必要な場面でも解いていくことが可能です。
定着問題
<定着問題1>
硫酸H2SO4 を49(g)、水酸化ナトリウムNaOHを80(g)を用意して中和反応を起こした。
反応後に余った反応物と、生成物のそれぞれの質量を求めよ。
<定着問題2>
標準状態で22.4(L)の窒素N2と44.8(L)の酸素O2をを反応させてアンモニアNH3が生成された。
この時、余った反応物と生成されたアンモニアの(標準状態での)体積を求めよ。
ただし、原子量はそれぞれ『H=1、Na=23、N=14、O=16、S=32』とする。
定着問題1のhints!酸塩基反応
問1では、硫酸と水酸化ナトリウムの中和反応を扱います。
定着問題2のhints!NH3生成反応と標準状態での気体の体積
問2はアンモニアの生成反応ですが、“標準状態でのmolと体積の関係”を確認する問題です。
(忘れていたら要チェック)『標準状態(0℃、1013hPa)において、どんな気体原子でも1molあたりの体積は22.4Lとなります。』
回答解説
では、解答、解説を行なっていきます。
定着問題1の解説
定着問題1は先ほどの問題と手順がほとんど変わりません。
硫酸と水酸化ナトリウムを正しくmolに変換できたか?という点と、生成物である「塩:硫酸ナトリウム」、「水」が分かれば同様に解いていくことができます。
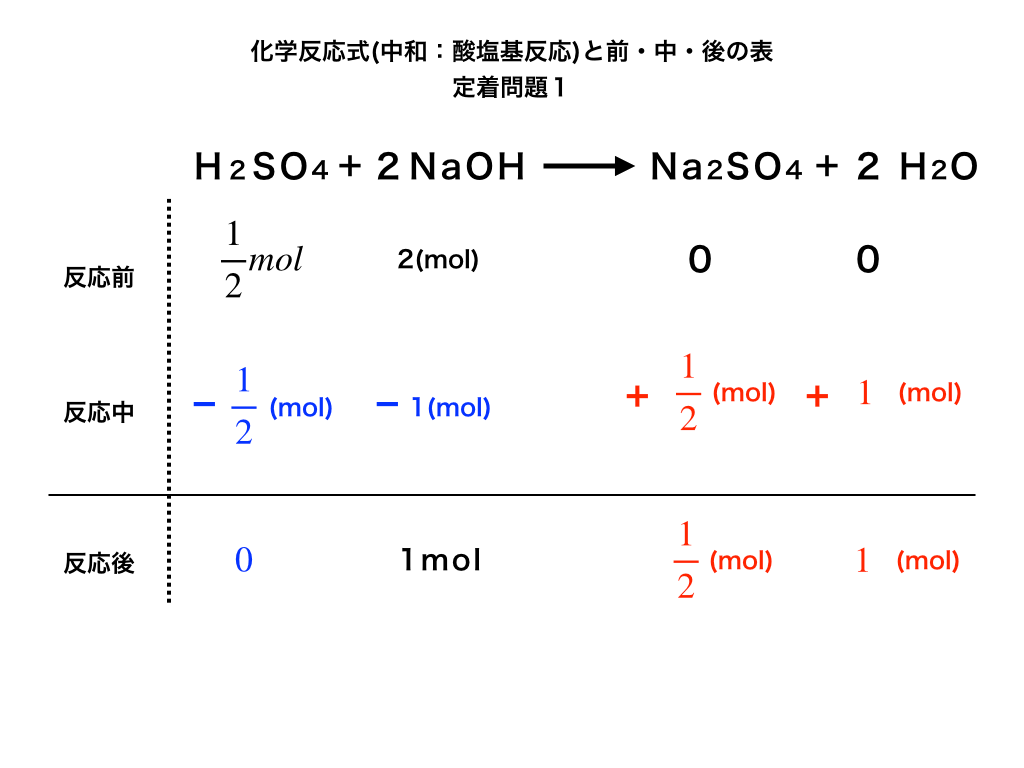
<定着問題の解説図1>
表を完成させて、
<答>:水酸化ナトリウム40(g)が余り、硫酸ナトリウム72(g)と水18(g)が生成された。
定着問題2の解説
問題2がこれまでと違う点は、上述した通り「(標準状態での)体積とmolの相互変換がきちんとできるか」です。
標準状態のもとでの窒素・酸素を、問題文の体積からmolに変換すると、それぞれ1mol、2molとなります。
いったんmolに変換した後は、これまでと同じく前・中・後の段を埋めていきます。
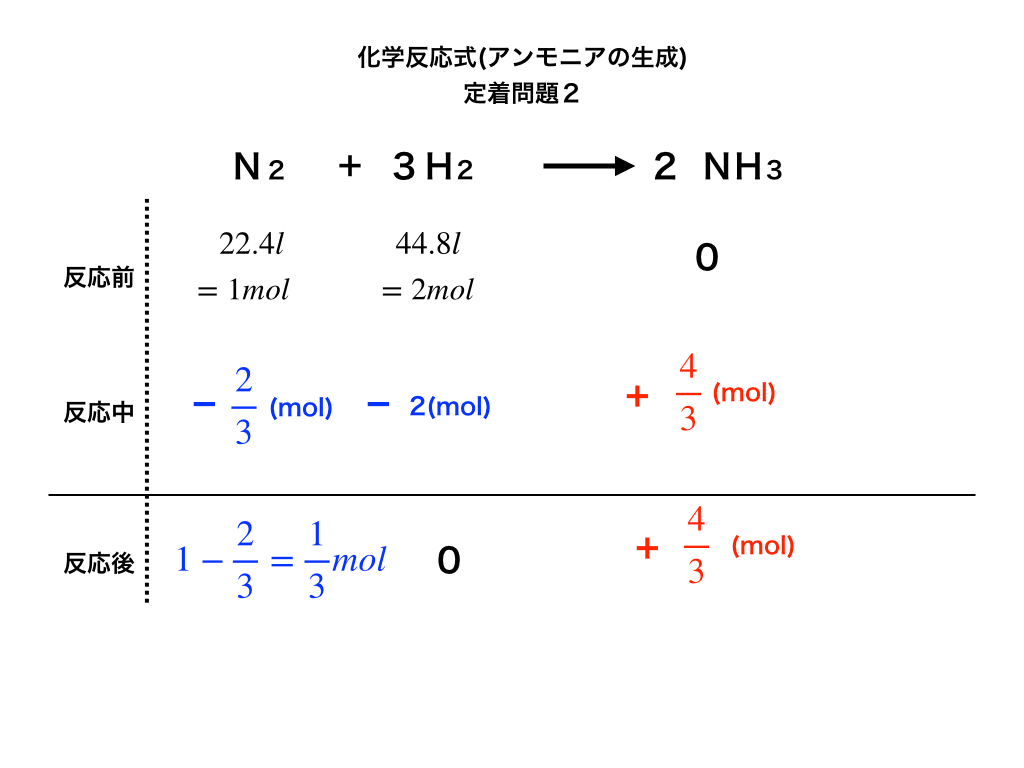
<定着問題の解説図2>
以上より、
・余った反応物は窒素で1/3(mol)、
・生成されたアンモニアは4/3(mol)
と求まったので、最後に標準状態での体積に変換しなおせば(答)です。
従って、(答):窒素は1/3(mol)・22.4(L/mol) ≒7.5(L)、アンモニアは4/3(mol)・22.4(L/mol)≒29.9(L)
化学反応(過不足)基礎編のまとめ
・過不足のある反応では、今回紹介した『反応前・中・後の表』さえ作ることが出来れば、ほとんどの問題に対応できます。
また、この表(図)はのちに学ぶ”平衡”などの分野でも利用することになるので、類題を探して今のうちにしっかりと作る練習をしておきましょう!
この記事の関連ページ
・化学反応式の係数は「反応式の係数を確実に決定する2つの方法」の記事(目算法・未定係数法の解説)
・弱酸・弱塩基の反応は「弱酸・弱塩基と電離度α、そして電離平衡」の記事(記事中の【電離平衡】の問題で表を使います。)
・今回も最後までご覧頂き、有難うございました。
・「スマナビング!」では、読者の皆さんのご意見/ご感想や、記事のリクエストの募集をコメント欄にて行なっています。
・お役に立ちましたら、いいね!、B!やシェア、サイトの公式Twitterのフォローをして頂けると、と励みになります。
・その他のお問い合わせ・ご依頼につきましては、お問い合わせページからご連絡下さい。

