
酸化還元反応(3)電気分解
今回は、酸化還元反応:第三回として、「電気分解」の解説を行なって行きます。
前回、前々回の記事をご覧になっていなければ、ぜひ先に(特に第二回)以下のリンクよりご覧ください。
第一回:「イオン化傾向とは?その覚え方と電池への応用」
第二回:「ダニエル電池の計算問題とファラデー定数」
目次(タップした所へ飛びます)
電気分解とは
電気分解とは、前回までの電池とほぼ真逆といえます。
電池は2枚の金属板(極板)間のイオン化傾向の差を利用して、
・『イオン化傾向が大きい金属から放出される電子e-電子』が、金属間をつなぐ電線を
・『イオン化傾向の小さい金属板』へ移動することによって、電気を取り出していました。
<図1:ダニエル電池>参照
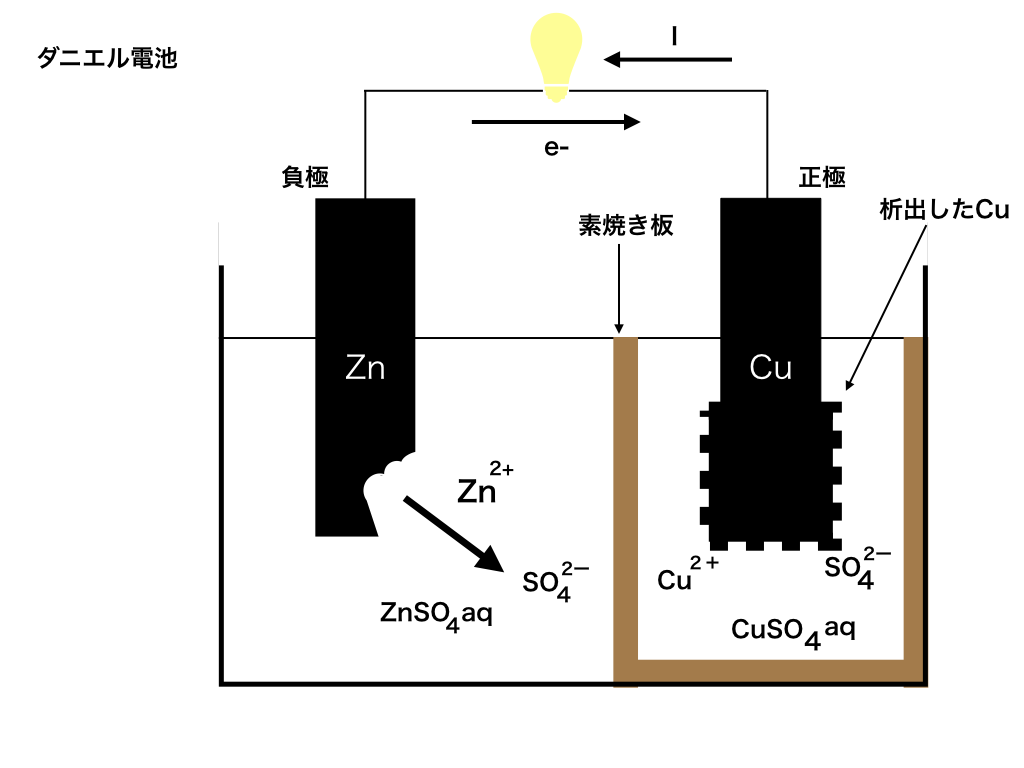
<図1:ダニエル電池>
一方で電気分解は、その回路に外部から電源を取り付けて、電気エネルギー(電子)を与えることにより、強制的に様々な反応(酸化還元反応)を起こすことを言います。
その最も有名な例の一つとして、「銅の電解精錬」を取り上げて見ます。「電気分解」のイメージをつかんでください。
銅の電解精錬(一部無機化学範囲)
銅は、身近にある金属ですがどのようにして作られているか知っていますか?
当然、元々は鉱石(主に黄銅鉱など)から銅を取り出すのですが、この過程では、純度(つまり全体の質量に対する純粋な銅の質量の度合い)が99%程度の「粗銅」までしか作ることが出来ません。
99%と聞くと高いようにも思えますが、不純物がほんの少しでも混ざると性質が大きく変わるので、さらに純度の高い銅を作らないといけないのです。
従って、この粗銅を純度が99.99%以上の純銅に精錬(せいれん)する必要があります。
この時、「電気分解」の仕組みを利用します。
<図2:銅の電解精錬>
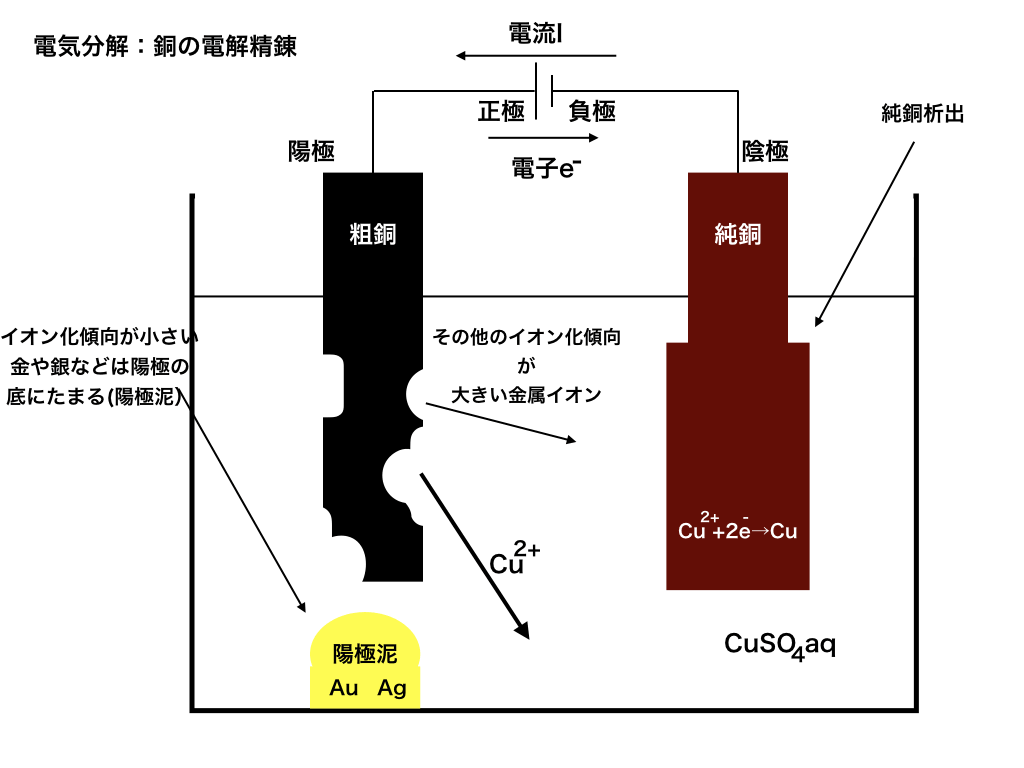
<図2:銅の電解精錬>
図2を詳しく解説して行きます。
電気分解の仕組み(陽極側)
まず、外部電源(回路上の電池の記号のところ)の正極と粗銅をつなぎます。この時、粗銅の方を陽極と言います。
一方、電池の負極と純銅をつなぎ(こちらは陰極)ます。
もし電源がなければ、ほとんど同一の金属板を繋げただけでなんの反応も起きないでしょう。
しかし、電源の力によって、電子が陰極(粗銅板)から吸い上げられて陽極板へと強制的に移動させられます。
\(\mathrm{Cu}\rightarrow \mathrm{Cu}^{2+}+ 2e^{-}\)
それと共に、銅イオン\(\mathrm{Cu}^{2+}\)は電解液中に溶け出します。
陽極泥とは
ここで重要なことは、「粗」銅には銅以外の金属が含まれているということです。
鉄や亜鉛、金、銀など様々な不純物が混ざっています。
これらのうち、イオン化傾向が大きい鉄や亜鉛などに関しては鉄イオン、亜鉛イオンなどとして溶けだします。
しかし、銅よりもイオン化傾向が小さい銀や金は(イオンになりたくないので)単体として陽極(粗銅板)の下に溜まります。
これを陽極泥と言います。
陰極側での反応
次に、電池の負極とつないだ陰極、すなわち純銅板をみていきましょう。
純銅板は、その名の通り不純物が(ほとんど)含まれない銅板です。
陽極から吸い上げられた電子が純銅板に入ると、電解液中に溶け出している\(\mathrm{Cu}^{2+}\)に電子を渡します。
他の金属イオンも溶けていますが、イオン化傾向が銅イオンよりも大きい
(=銅イオンよりはイオンでいたい)ので、銅イオンが電子を受け取り、銅が析出します。
この反応によって、純銅板の周りに純銅がくっ付いていくので上手く粗銅から純銅を得ることができるのです。
いかがでしょうか、電気分解の仕組みや意義が少し理解できたかと思います。
繰り返すと、
「通常ならば起こりえない反応を起こすために、外部から強制的に電気エネルギーを与えること」=「電気分解」
「イオン化傾向の差から自然に起こる反応を利用して、電気(電子)を外部へ取り出す」のが=「電池」
電気分解の極板でのルール
ここからは、様々な電気分解で共通のルールを紹介して行きます。
このルールをしっかり理解しておけば、どんな電気分解でも対応できます。
陽極板での電気分解のルール
では、外部電源の正極とつないだ「陽極」でのルールを解説します。
1:陽極板が白金Ptや炭素Cでできている場合。
特にイオン化傾向の小さい白金などはイオン化=溶け出す事はせず、代わりに電解液中に存在する陰イオン(陰イオンということは、電子が余っているので)から電子を奪って、その陰イオンを酸化します。
とはいえ、電解液中には様々な陰イオンが存在するので、どのイオンが酸化されやすいのか順序が決まっています。
1−1:ハロゲン化物イオン(F-,Cl-,Br-,I-)がある場合
ハロゲン化物イオンが電解液中にあれば、そのイオンから電子を奪い、そのハロゲンが発生します。
(例)\(2\mathrm{Cl}^{-}\rightarrow \mathrm{Cl}_{2} + 2e^{-}\)
1−2:ハロゲン化物イオンがなく、陰イオンが
\({\mathrm{SO}_{4}}^{2-}や、{\mathrm{PO}_{4}}^{3-}、もしくは{\mathrm{NO}_{3}}^{-}\)
しかない場合には、酸素が発生します。
この時、電解液が塩基性か、中性/酸性かの2通りで異なる反応式になります。
(中性/酸性の場合):\(2\mathrm{H}_{2}\mathrm{O}\rightarrow 4\mathrm{H}^{+}+4e^{-}+\mathrm{O}_{2}\)
(塩基性の場合):\(4\mathrm{OH}^{-}\rightarrow 2\mathrm{H}_{2}\mathrm{O} +4e^{-}+\mathrm{O}_{2}\)
2:次に、極板に白金よりもイオン化傾向の大きい金属を使った場合、
陽極板は先ほどの「銅の電解精錬」でも見た通り、電子を吸い上げられます。
別の言い方をすると、電子を奪われることから「酸化する」とすることもできます。
すなわちイオン化傾向が銀以上の金属が使われている場合、極板それ自体が溶け出し(酸化)します。
これは上の<銅の電解精錬>でみたとおりです。
陰極板での電気分解のルール
次に電源の負極とつないだ陰極です。
陰極では、移動してきた電子を電解液中のどのイオンに渡すか(イオンを還元するか)、
つまり、電解液中にある陽イオンの種類によってルールが決まっています。
1:電解液中に銀イオン、銅イオンがある場合
\(\mathrm{Ag}^{+},\mathrm{Cu}^{2+}\)は電子を得て銀、銅が析出します。
(銅の電解精錬の陰極での反応はこのタイプです)
\(\mathrm{Ag}^{+}+e^{-} \rightarrow \mathrm{Ag}\)
2:電解液中に銀イオン、銅イオンがない場合
水素が発生します。
この反応も、電解液が酸性の場合と中性/塩基性の場合で反応が変わります。
(酸性の場合):\(2\mathrm{H}^{+}+2e^{-}\rightarrow \mathrm{H}_{2}\)
(中性/塩基性の場合):\(2\mathrm{H}_{2}\mathrm{O}+2e^{-} \rightarrow \mathrm{H}_{2}+2\mathrm{OH}^{-}\)
電気分解まとめと次回へ
・電気分解のルールは沢山あって、式も混乱しやすいですが、なるべく「理解」しながら身につけていきましょう。
その際に【イオン化傾向】が役立ちます。
・以下にイオン化傾向の第1回と第2回へのリンクをはっているので、
電気分解のルールを意識しながら復習しておいてください!
第一回:「イオン化傾向とは?そしてボルタ電池とダニエル電池」を読む。
第二回:「ダニエル電池の計算問題とファラデー定数とは」を読む。
第三回:今ここです。
第四回:「イオン化傾向とイオン化エネルギーの違いとは?」を読む。
第五回では、引き続き電気分解を詳しくみていきます。
また、良くある疑問の一つである、「イオン化傾向(イオン化列)とイオン化エネルギーの違い」についても詳しく解説します。
今回も最後までご覧いただき有難うございました。
お役に立ちましたら、シェア&当サイト公式Twitter(@linkyjuku_tweet)のフォローをお願いします!
質問・記事について・誤植・その他のお問い合わせはコメント欄、もしくは公式Twitterまでお願い致します。

