鉛蓄電池が苦手な人向け!仕組み/反応式~計算問題の解き方まで総まとめ
<この記事の内容>:酸化還元分野(電池)より、苦手な人が多い”鉛蓄電池”をイラストを用いながら、”なるべく分かりやすく”正極・負極それぞれでの反応や、質量変化の計算問題の解法を紹介していきます。
<電池・電気分解などの復習>:「酸化還元分野の記事まとめ」左リンク先ページで、酸化・還元の定義から各種電池・電気分解・CODといった発展的な事項までまとめていす。
目次(タップした所へ飛びます)
鉛蓄電池とは
”鉛蓄電池”は「ボルタ電池やダニエル電池」などの、"放電"のみしか出来ない一次電池と違い”充電”ができる二次電池であることが最大の特徴です。
では早速、ここからその仕組み〜各極板での反応を解説します。
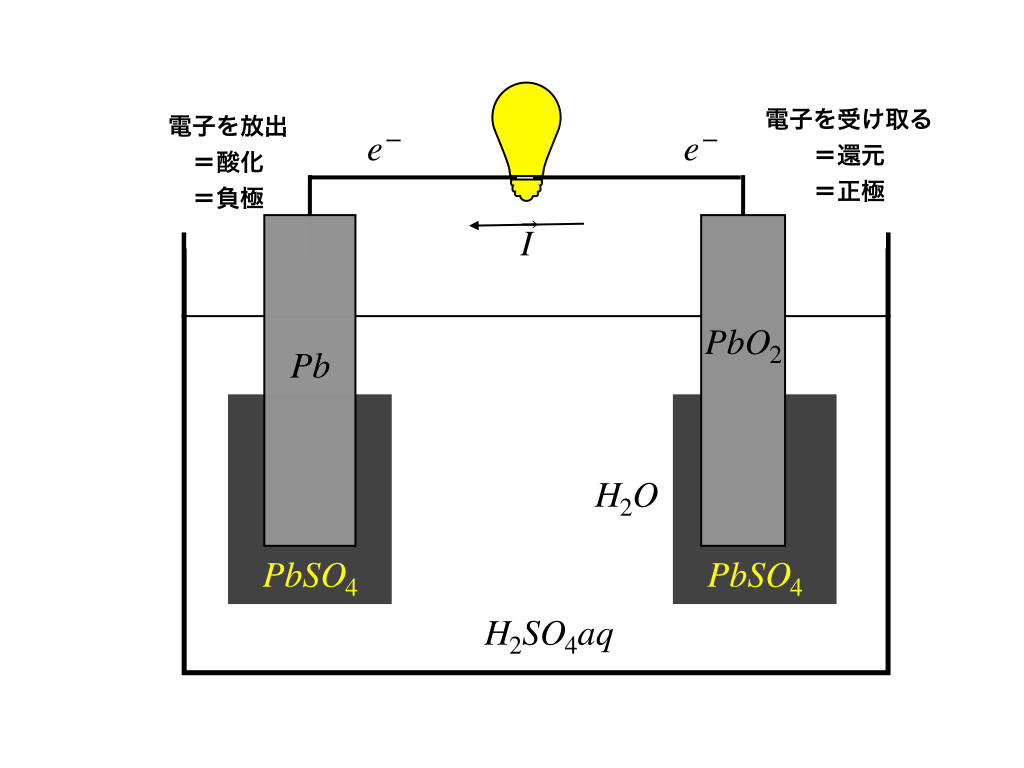
鉛蓄電池の仕組み・構造
まずは全体図を見てみましょう。
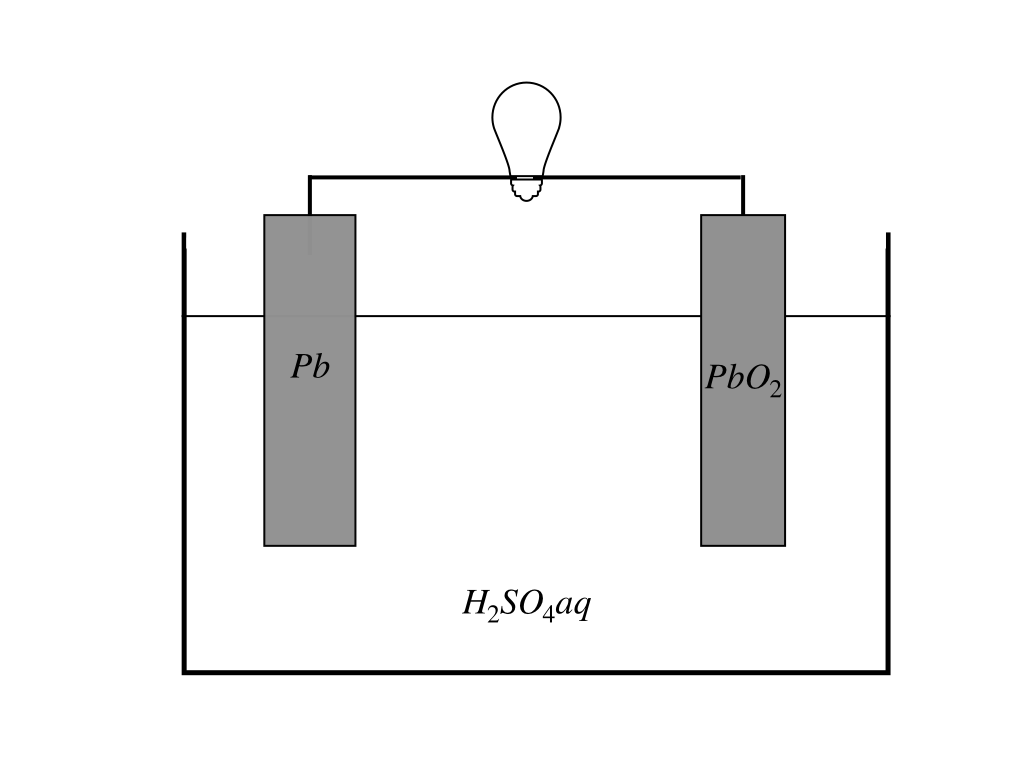
<鉛蓄電池の構造>
極板のうち片方はPb(鉛)もう片方がPbO2(二酸化鉛)、そして電解液には希硫酸H2SO4を用います。
ここで双方にある”Pb”の酸化数<参考:「酸化数のルールと酸化剤・還元剤の見抜き方」>を調べると、鉛のみの極板は”0”、二酸化鉛の方は酸化数は”O2”が-4,全体で0より”+4”となります。
このように、2つの極板は同じ”Pb”を含みますが、酸化数の差に現れているように、酸化・還元のしやすさ=(電子を放出/受け取りやすさ)が異なります。
この違いを利用して、電子をやりとりすることで電流を流し電池となります。
正極での反応
ではどちらが正極になるのか考えてみます。
『正極は電子を受け取る方』だったので、PbO2が電子を受け取って還元されます。
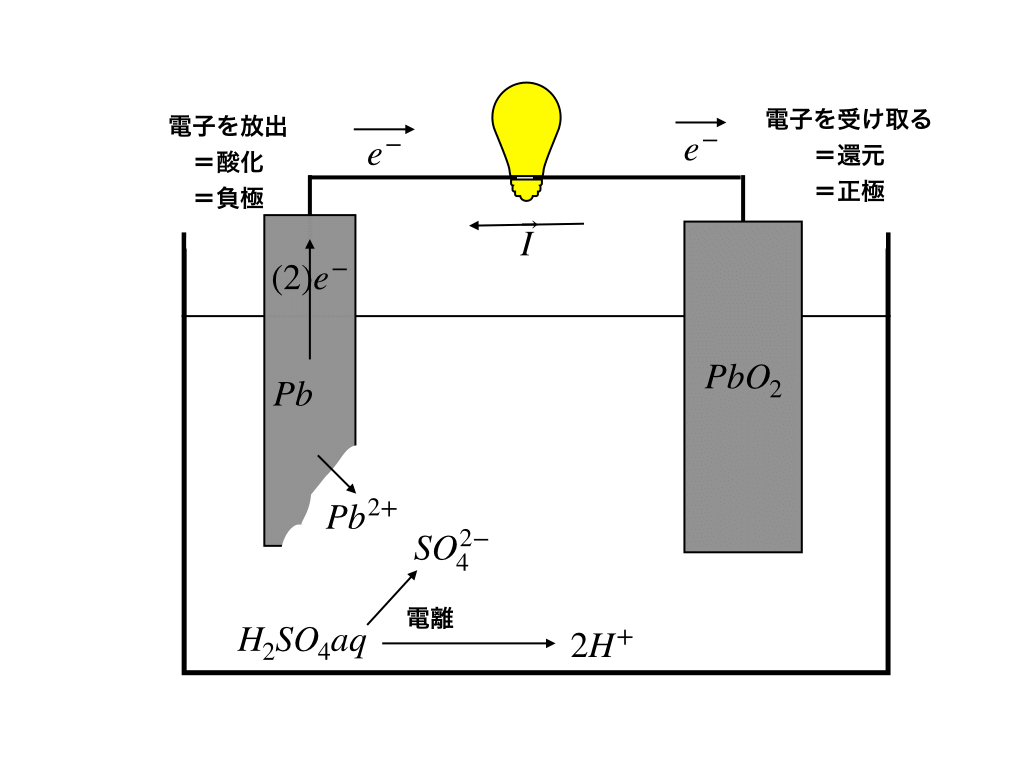
<鉛蓄電池と電子の移動>
では、『電子を受け取った時』のPbO2はどのような反応をするのか?に注目してみましょう。
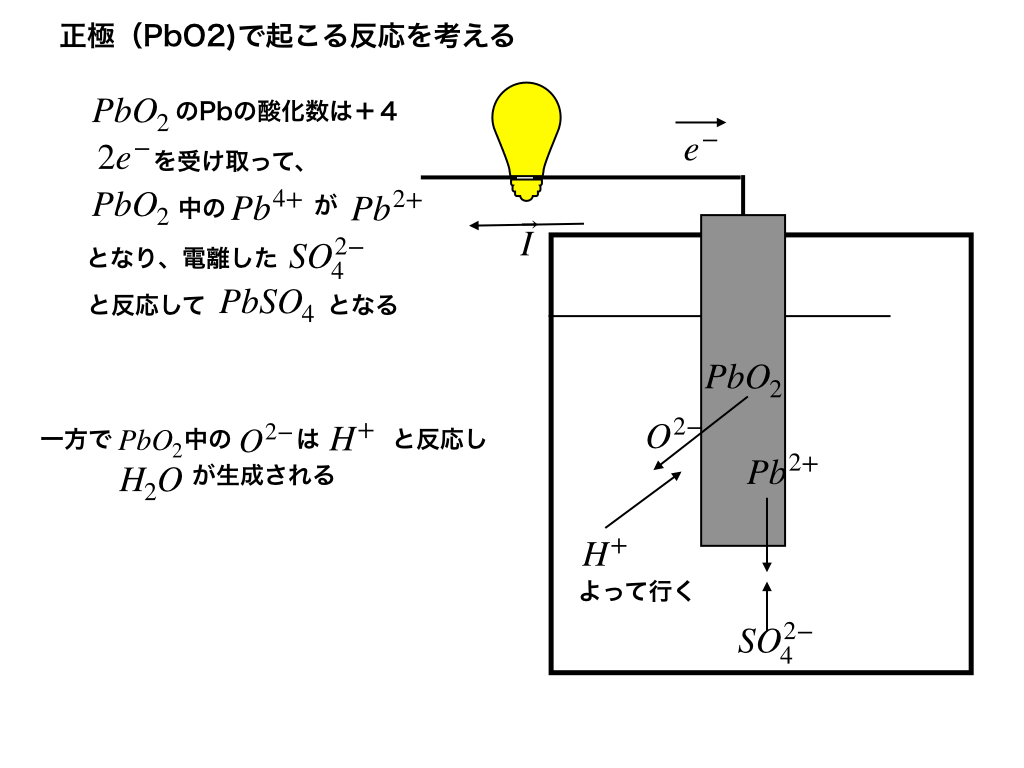
<正極での反応(詳細)>
上のイラストに書いた通りなのですが、電子を受け取ることによって”酸化数4”の鉛イオン(Ⅳ)は”酸化数2”の鉛イオン(Ⅱ)となって、希硫酸より電離した硫化物イオンと反応します。
これによりPbSO4が正極板に付着することとなります。
(この極板に付着したPbSO4と、元々の極板PbO2の”質量の差”を求める問題を後の項で紹介しています。)
さらにPb4+と結合していたO2-と、電解液中に存在する水素イオンH+の反応も考えて正極での反応式をまとめると、\(PbO_{2}+4H^{+}+SO_{4}^{2-}+2e^{-}\rightarrow PbSO_{4}+2H_{2}O\)・・・(1)という式が出来上がります。<参考:「半反応式の作り方と酸化還元滴定の解説」等>
負極での反応
次に負極での反応を見ていきましょう。
正極の反応のところで示したイラストをもう一度掲載します。

<負極でのPbの反応>
負極では、\(e^{-}\)を放出するために\(Pb\rightarrow Pb^{2+}+2e^{-}\)の反応が起こります。
電解液中にはSO42-が存在するので(希硫酸より電離した硫化物イオンと反応)するので、負極の反応をまとめると、\(Pb+SO_{4}^{2-}\rightarrow 2e^{-}+PbSO_{4}…(2)\)。このPbSO4が負極板に付着していきます。
全体としての反応
では、正極の反応と負極での反応を合わせて全体の反応を作っていきます。
<鉛蓄電池:全体反応>
正極の反応(1)と負極の反応(2)を考えて合わせることで、
正極は\(PbO_{2}+4H^{+}+SO_{4}^{2-}+2e^{-}\rightarrow PbSO_{4}+2H_{2}O…1\)、一方負極では:\(Pb+SO_{4}^{2-}\rightarrow 2e^{-}+PbSO_{4}…(2)\)
よって、$$(1)+(2)=PbO_{2}+Pb+4H^{+}+2e^{-}+2SO_{4}^{2-}$$
$$\rightarrow 2H_{2}O+2PbSO_{4}+2e^{-}$$が成り立ちます。
さらに整理することで、\(PbO_{2}+Pb+2H_{2}SO_{4}\rightarrow 2PbSO_{4}+2H_{2}O\)の式ができます。これが鉛蓄電池の”放電時の”反応式です。
充電時は逆の反応が起こる!
さて、鉛蓄電池の最重要な特徴は二次電池、つまり充電ができるというものでした。
実際に充電を行うと、次のように放電時と真逆の反応が起こり、\(PbO_{2}+Pb+2H_{2}SO_{4}\leftarrow 2PbSO_{4}+2H_{2}O\)、充電が終了すると再び放電が可能になります。
鉛蓄電池の計算(質量変化)問題
鉛蓄電池に関する問題で最も難しく感じる人が多いのが、この『放電後の極板の質量変化』です。
しかし、上の項で作った全体の反応式+その係数比が分かっていれば案外あっさり解けることが多いです。実際に例題を通して解法を見ていきましょう。
問題
今、鉛蓄電池を放電した際に4(mol)分の電子が流れた。この時、負極と正極におけるそれぞれの質量の変化分を求めよ。
解答と解き方のコツ
まず、ここで重要なことは次の2式の係数比をチェックすることです。
正極での反応:\(PbO_{2}+4H^{+}+SO_{4}^{2-}+2e^{-}\rightarrow PbSO_{4}+2H_{2}O…1\)そして、負極での反応:\(Pb+SO_{4}^{2-}\rightarrow 2e^{-}+PbSO_{4}…(2)\)これによって、
正・負の両極とも、電子の係数2の半分である1だけ、極板が以下のように変化することがわかります。
$$正極:PbO_{2} →PbSO_{4}、負極:Pb→PbSO_{4}$$
すなわち、4(mol)の電子ならば
正極:2(mol)分PbSO4-PbO2=SO2 だけ質量が増加して、もう片方の
負極:2(mol)分PbSO4-Pb=SO4 だけ質量が増加します。
ここで、SO2:64(g/mol)、また、SO4:96(g/mol)より、今回はこの2倍だけそれぞれ重くなります。
解答:正極では128(g)・負極では192(g)質量が増加する・・・(終)
鉛蓄電池まとめと電気化学の関連記事
・鉛蓄電池は正/負極両方にPb(鉛)が含まれており、反応式も複雑なので”酸化数”の考え方も取り入れながら”反応式を暗記”するのではなく、なるべく自分で作れるように復習しておきましょう。
・計算問題については、”流れた電子のmol数の半分のmol数”ぶん、SO4(負極)・SO2(正極)で質量が増加することを抑えておけば大抵の問題はクリアーできます。
・電気化学(酸化還元)次回は『燃料電池(リン酸型・アルカリ型)の仕組み』を解説します(作成中)。
酸化還元分野のまとめ記事とリチウムイオン電池
この記事で2次電池を理解できれば、次は鉛蓄電池と同様の”充電”・”放電”ができる2次電池として「リチウムイオン電池の構造と仕組み」を続いて読んでみましょう。
現在作成中:「燃料電池の仕組みと問題(リン酸型・アルカリ型)」
関連記事:「酸化還元反応を0からわかりやすく!」<<酸化還元・電気化学分野の総まとめページです。わからないことがあればこのページから探してみてください。
今回も最後までご覧いただき有難うございました。
「スマナビング!」では、読者の皆さんのご意見や、記事のリクエストの募集を行なっています。
ご質問・ご意見がございましたら、是非コメント欄にお寄せください。
お役に立ちましたら、画面下のシェアボタン(スマートフォンの場合)でシェアをしていただけると励みになります。
・その他のお問い合わせ/ご依頼に付きましては、お問い合わせページからご連絡下さい。

