
電子式と電子対・配位結合をマスター!
<記事の内容>:原子の周りに『:』(電子対)や『・』(不対電子)といった”点”がついているいわゆる『電子式』の意味や、価電子、様々な電子対について解説します。
更にその応用として、非共有電子対を用いた【配位結合】も併せて詳しく紹介しています。
<参考記事>:「化学式の種類と性質まとめ」、「電気陰性度で共有/イオン/金属結合を解説」
【目次のタップ/クリックで目的の項へ飛べます】
目次(タップした所へ飛びます)
電子式とは
電子式とは、元素のまわりを最外殻電子の数だけ・で表したものです<下の図1参照>。
この考え方は、今後無機化学や有機化学でもとても大切になってきます。
電子式の例と書き方
電子式は基本的にそれぞれが離れるように【・】を配置し、不対電子を価標と呼ばれる(Hー)線を用いて書くことがあります(特に有機化学)。

<図1:電子式と様々な電子対>
電子対とは
電子2つがペア(対)になって様々な結合や反応が起きます。
ここでは電子対の種類などについて見ていきます。
不対電子とは
まずは、<上図1>で紹介している通り、水素は最外殻電子が1つ(=価電子1つ*)なので電子式では『H・』と表記します。
ペアーになっていないのでこれを「不対電子」という風に呼びます。
*:価電子は基本的に最外殻の電子数と一致しますが、反応性の極めて低い希ガス(18元素)のみ”0”とするように決まっています。
共有結合と電子対
不対電子がある原子は安定的な電子配置である、希ガス型(He型なら二個、Ne型なら八個、)になるように別の原子と電子を共有し合う『共有結合』をします。
<下図はNとHの共有結合>
そして、共有結合によって”不対”から”対”になった電子(下の図2の黄色部分参照)を共有電子対、
Nの上2つの電子のように共有結合に関わらない電子対を『非共有電子対』(同、点線で囲んである部分)とそれぞれ呼びます。
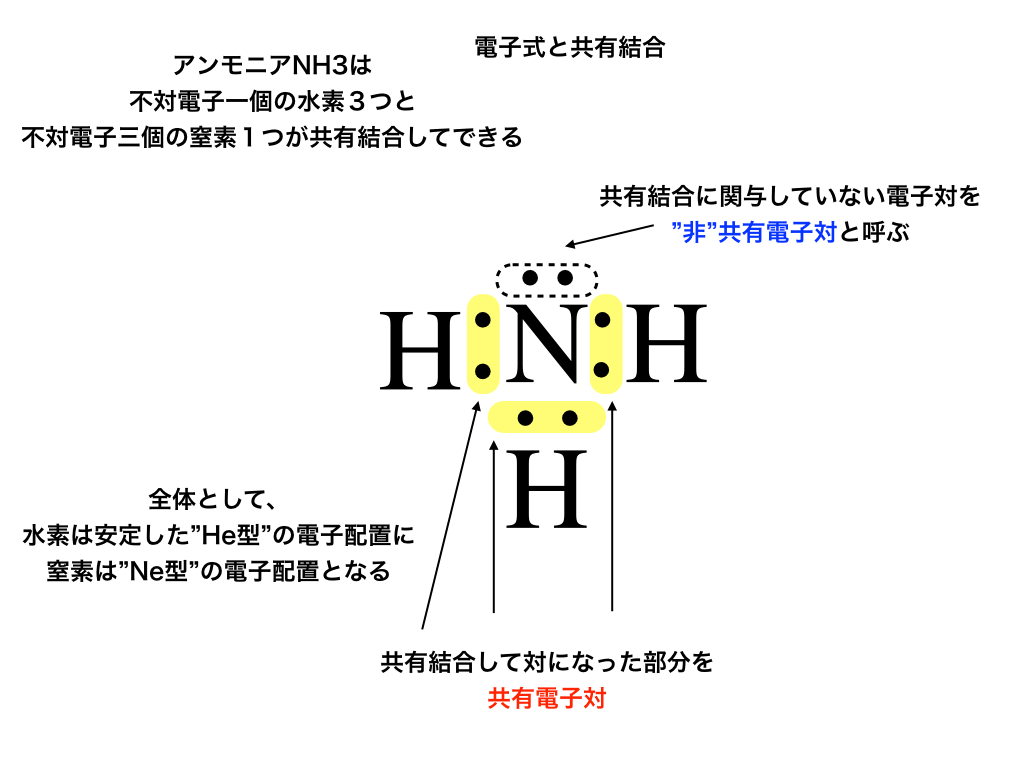
<アンモニアと電子式:図2>
なお、この非共有電子対は”配位結合”や”錯イオンの形成”において非常に重要な役目を果たすので、次の項で詳しく解説します。
配位結合と錯イオン
ここからは理論・無機分野で特に苦手な人が多い『配位結合』・『錯イオン』などを学びます。
なお、「電気陰性度で理解する化学結合一覧」で、基本的な結合については解説しています。ぜひ参考にしてください。
非共有電子対と配位結合が起こる仕組み
下の<図3>と、上で解説した<図2>のように、\(\mathrm{NH_{3}}\)の上には非共有電子対が残されています。
ここに、電子が1つ無くなって、かつ中性子も存在しない水素イオン\(\mathrm{H^{+}}\)(=陽子:プロトン)があれば、この非共有電子対が結合することによって
・水素イオンはHe型(=安定)の電子配置になり、
・アンモニアはすべての電子対が共有電子対となることができます。
配位結合の具体例
点線で囲った部分がうまく結合(=配位結合します)。
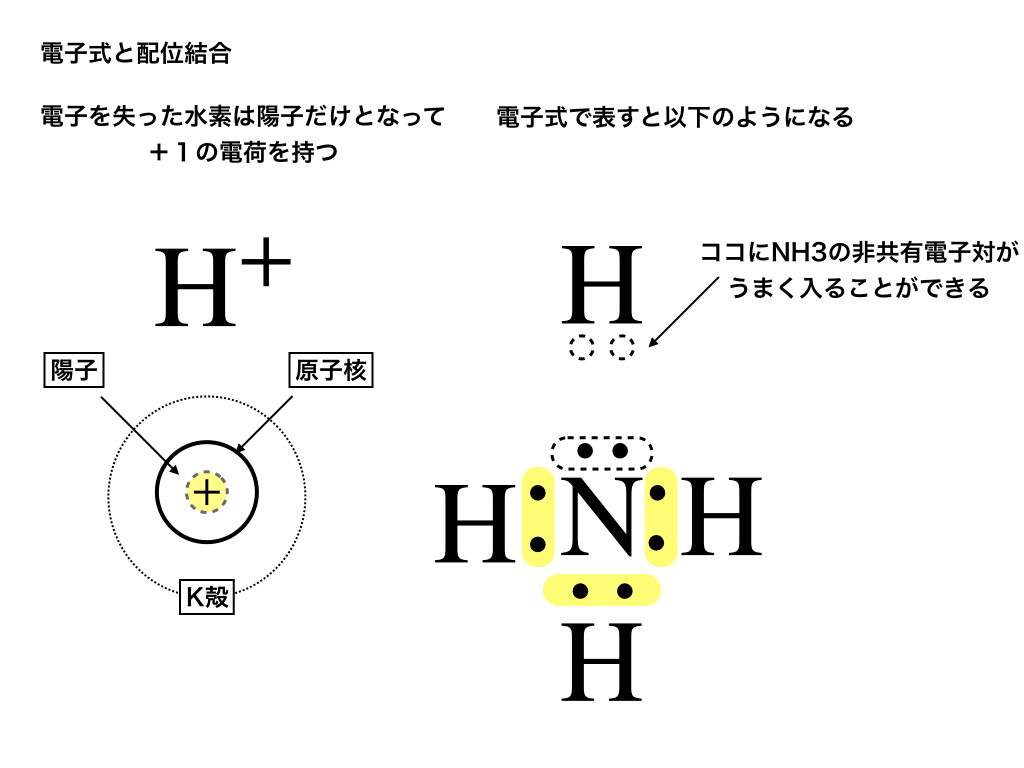
<図3:アンモニアと水素イオンの配位結合>
配位結合とイオン式(有名なもの)
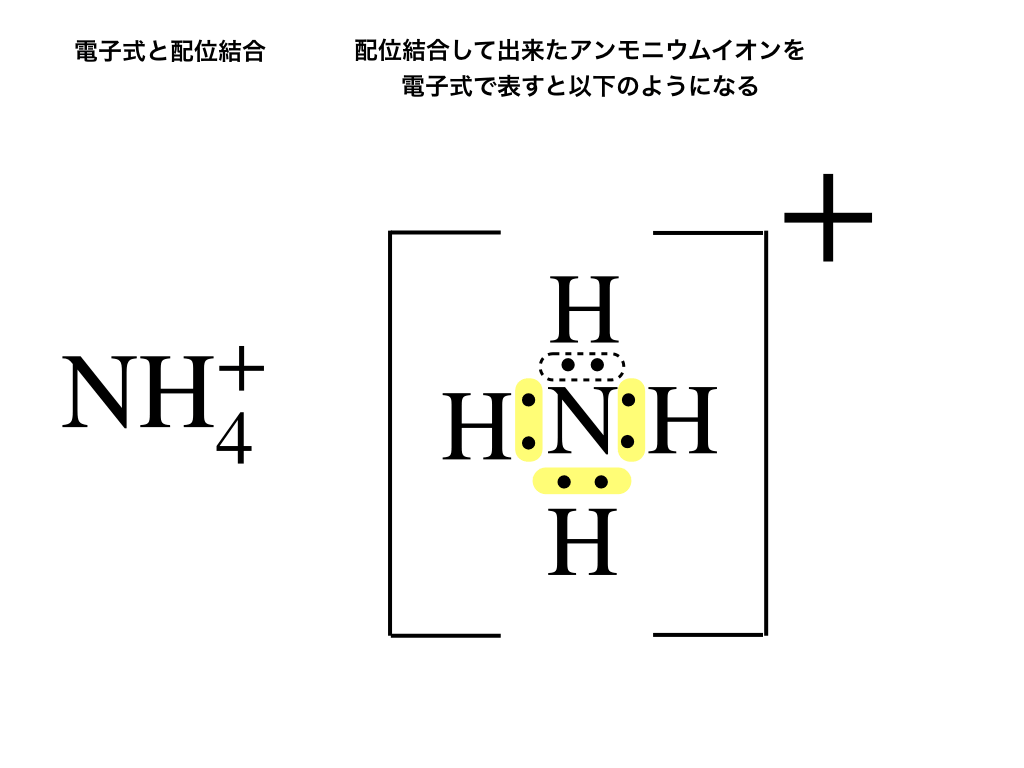
このようにして出来たアンモニウムイオンは電子式では<下図4:右側>のように書き、イオン式では\(\mathrm{NH_{4}^{+}}\)と表記します。
もともとアンモニアは\(\mathrm{NH_{3}}\)と、電荷がプラスマイナス0であったのに対して、
水素イオンは+1の正電荷を帯びていたので、結果的に\(\mathrm{NH_{4}^{+}}\)と一価の正電荷を帯びたということです。
他にもオキソニウムイオン\(\mathrm{H_{3}O^{+}}\)などが、特に有名な配位結合の例としてよく登場します。
なお、これもよく試験などで問われますが、一度配位結合が起こると、どの電子対がもともと共有結合に関与していた電子対だったのかはわからなくなります。
錯イオン(無機導入)
ここまで電子対の種類や配位結合、電子式を見てきました。
金属イオンに対して”アンモニア”や”水酸化物イオン”などが似たような仕組みで結合し、錯イオンができることがあります。
(下図参照)次回はそんな『錯イオン』について覚え方やルールなどを詳しく紹介していきます。
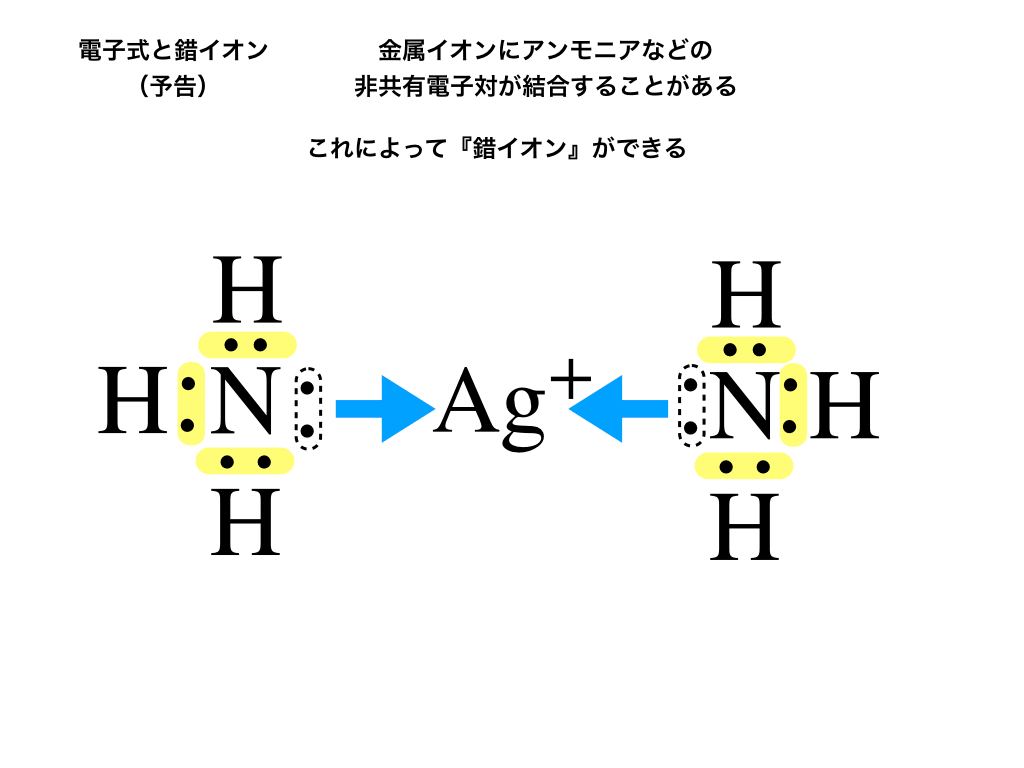
\([\mathrm{Ag(NH_{3})_{2}}]^{+}\):ジアンミン銀(Ⅰ)イオンの反応例。
電子式/電子対・価電子から配位結合までまとめ
さて、今回は
・電子式の意味と書き方から、
・電子対の種類、
・共有結合と配位結合の仕組み、
錯イオン(無機)の導入までを解説しました。
いずれも冒頭で書いたように、有機・無機・理論と化学全般にわたって基本となる考え方なので、しっかりと定着させていきましょう。
関連記事と無機分野の錯イオンへ
タイアップ等のお問い合わせはスマナビング!:「運営元について」のページより受け付けております。

