同位体と同素体を詳しく説明
<このページについて>:間違えやすい同位体と同素体について、それぞれの意味、覚え方、入試で問われるpointをまとめました。
目次(タップした所へ飛びます)
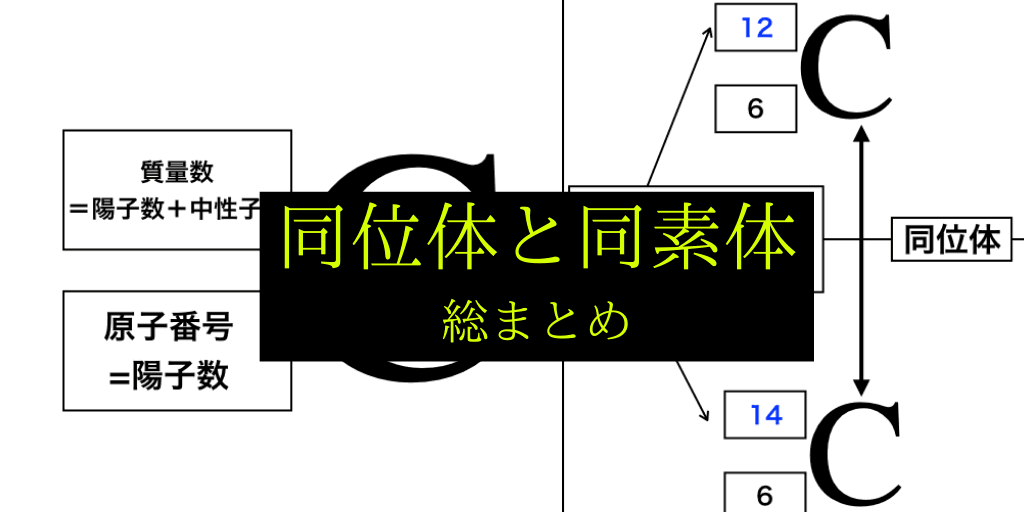
同位体とは
同位体と同素体の内、この項では「原子核中の中性子の数の違い」によってできる同位体から解説していきます。
質量数と原子番号から復習
同位体の理解に欠かせないのが、元素の左下・左上に表記されている『原子番号』と『質量数』です。
まずはこの分野から復習していきます。
(※:手元の教科書や参考書などに周期表が載っていれば、それを広げつつ見ていきましょう。)
原子の構造と同位体
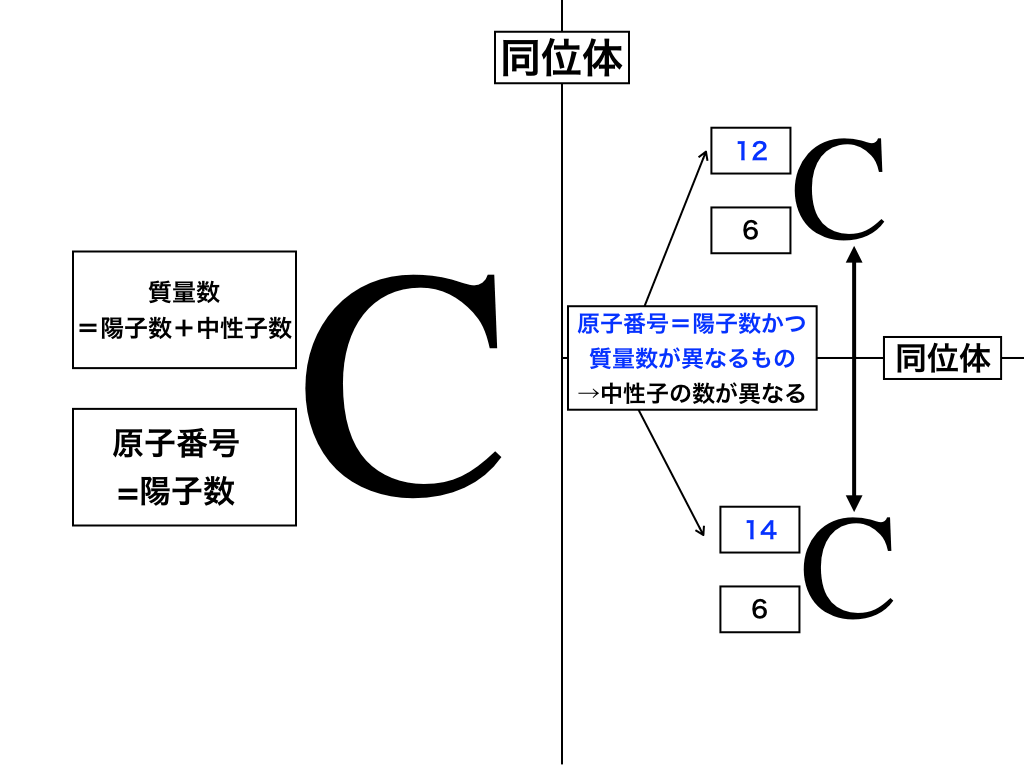
上の炭素の例で解説していきます。
周期表の順番(番号)と一致する原子番号はその【元素の陽子の数と等しい】のでした。(これを左下に書きます)
原子は基本的に、陽子・中性子・電子から成り(そして電子の質量が無視できるほど小さいため)
【陽子+中性子の数】を【質量数】として左上に表記します。
放射性同位体(ラジオアイソトープ)とは?
ラジオ(=放射性)アイソトープ(=同位体)とは、同位体の中でも(不安定な同位体がさまざまな種類の崩壊を起こす際に)放射線を放つ(=放射能を持つ)ことものです。
(※:放射能を持つ、【放射性同位体しか存在しない元素】も存在します)
炭素年代測定法とは?意味と仕組み
一番入試の題材にされるのが、\(_{6}^{14}\mathrm{C}\)質量数14の炭素です。
植物が生きている間は光合成などの活動によって空気中から吸収され、一定の比率を保ちますが、枯れるとそれ以上吸収され無くなります。
結果として、半減期:(半減期については、「半減期の式を微分方程式で導出」で詳しく解説しています)が過ぎるごとに1/2,1/4,1/8・・・と減っていきます。
一方で、放射性同位体ではない\(_{6}^{12}\mathrm{C}\)は減少することなく存在し続けるため、
この2つの炭素の比を求めることによって、その植物の枯れた時代や(その植物を食事にしていた動物・木造の建物など)周囲の遺跡の年代を特定するために利用されています。
同位体の存在比が特徴的なケース(相対質量)
下で紹介する”塩素Cl”のようなケースを除いて、多くの元素はメインとなる同位体の割合が非常に大きく、それ以外は存在率が非常に低いです。
ex:水素の同位体の存在比率(厳密にはもっと細かいです。)
\(_{1}^{1}\mathrm{H}は99.98\%\)、\(_{1}^{2}\mathrm{H}は0.01\%\)、\(_{1}^{3}\mathrm{H}は限りなくゼロに近い\)
例外&頻出問題である塩素について下の計算問題を使ってみていきます。
計算問題(Cl)
例えば塩素原子の同位体は、他の元素の同位体に比べて
1種類にそのほとんどが集まるようなことはなく、2種類の同位体が多くの割合を占めます。
\(^{35}\mathrm{Cl}と^{37}\mathrm{Cl}\)がそれぞれおよそ75%と25%の比率で存在するので、質量は\(35\times 0.75 +37\times 0.25=35.5\)
実際、周期表にも”35.5”かほぼその値に近い数字が表記されています。
同素体とは
同素体とは、同じ元素の単体から構成されるものの、その性質などが異なるもののことを言います。
覚えるべき同素体”SCOP”
同素体で覚えておかなければいけないのは、S・C・O・P(いわゆる語呂合わせで『スコップ』と覚えます)の4元素×それぞれの元素の同素体の種類↓です。(全部で11種類ほど)
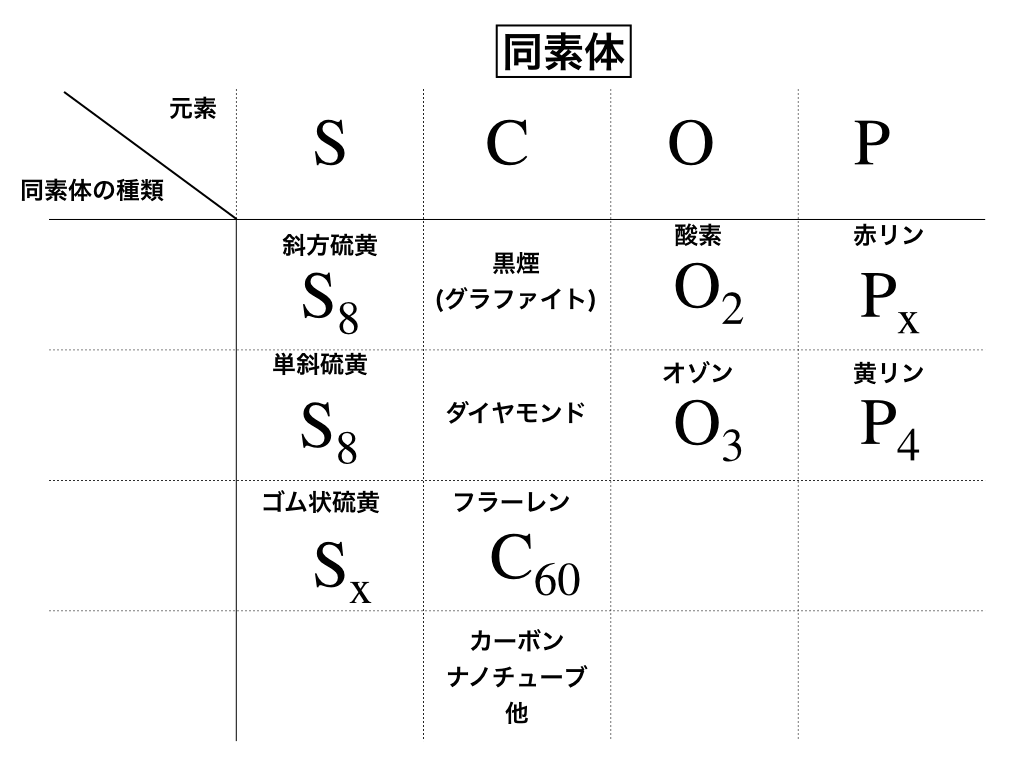
それぞれの同素体の種類・特徴を見ていきましょう。
S:硫黄(単斜硫黄と斜方硫黄に注意)
さて、同素体4種類の中で最も忘れやすく、得点率が低いのがS:硫黄です。
名前が似ている上、構造や分子式の違いにも注意が必要です。
単斜硫黄:\(\mathrm{S_{8}}\)と
斜方硫黄:\(\mathrm{S_{8}}\)と
ゴム状硫黄:\(\mathrm{S_{x}}\)
これらの外見としての区別が、単射硫黄はトゲトゲと針の山のような形をしている結晶なのに対して
斜方硫黄は(一般的な:安定した)結晶、
ゴム状硫黄は名前のとおりに、輪ゴムのようにつながった長い糸のような形状をしています。
(教科書等の無機化学の分野or同素体のところに実際の写真が載っているはずです。)
C:炭素~黒鉛らカーボンナノチューブまで~
黒鉛;グラファイトとも呼び鉛筆の芯などで有名です。導電性あり。
以下の図のように、構造は正六角形の共有結合が続く層が、上下に弱いファンデルワールス力によって引き合っている多層構造です。
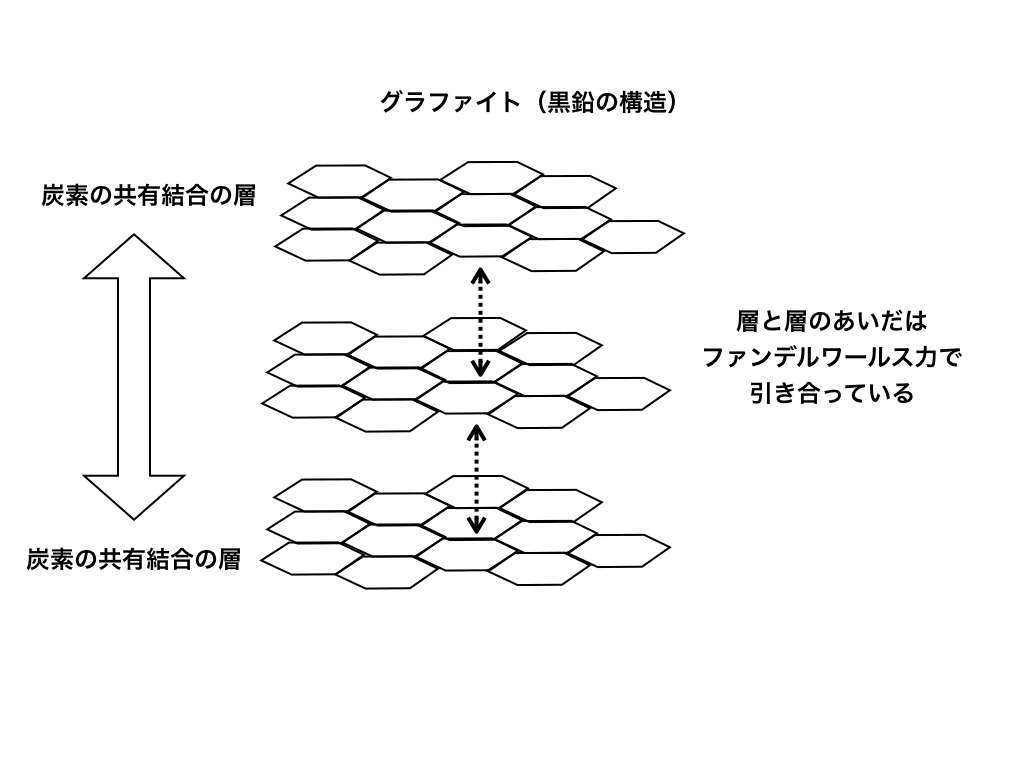
<グラファイト>
・ダイヤモンド:炭素がその4つの手(「電子式と価標」で解説)を、全て他のCと共有結合することによってできる共有結合結晶です。導電性なし
・フラーレン:サッカーボールのように炭素が球形に集まったものです。\(\mathrm{C_{60}やC_{72}}など\)
・カーボンナノチューブ:新素材(非常に軽く、強い)としても利用されているものです。
O:酸素とオゾン
\(\mathrm{酸素O_{2}とオゾンO_{3}}\)
酸素の性質は言うまでもないかと思いますが、オゾンは淡青色で酸化力があります。
そこで、下水処理場などで水を綺麗にするために使われたり、地球の上層部で太陽からの紫外線を吸収して酸素となることで、地上に有害な宇宙線が降り注がない役目を果たしてくれています。
(この層が温室効果ガスなどによって破壊されている現象を『オゾン層の破壊』と言っています。)
P:リン
リンは2種類の同素体を覚えておきましょう。
有毒な\(黄リン\mathrm{P_{4}}\)と
マッチ箱に使われる\(赤リン\mathrm{P_{x}}\)
黄リンは極めて反応性が高いので、灯油中に保管します。
また、赤リンの分子式ではxとなっている点が要注意ポイントです、
同素体と同位体の違いまとめ
・同位体は原子番号が同じで中性子数が違うもの
・同素体は同一元素の単体からなるものの、その性質が異なるもの
(一部の元素:S,C,O,Pを覚える!)
関連記事へ
最後までご覧いただきまして、有難うございました。
【受験メディア】:「スマナビング!」では、皆さんのからのご感想を募集しています。
(※):個々の問題などには対応出来ないことがあります。)
・その他のご依頼、タイアップ等につきましては、運営元ページより直接ご連絡下さい。

