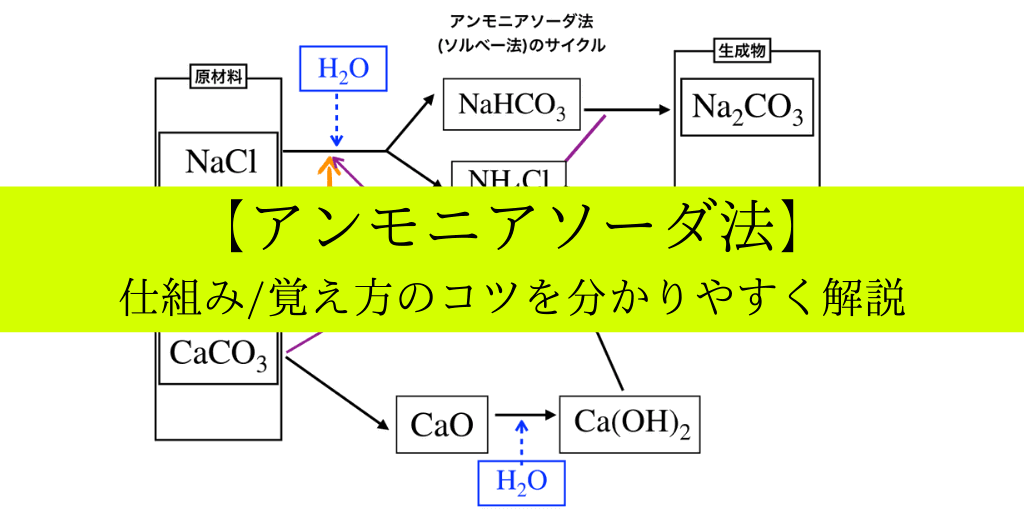
アンモニアソーダ法の覚え方/仕組み
この記事では、”炭酸ナトリウム”の工業的製法である、無機の中でも覚えづらさがトップレベルのソルベー法(或いは、アンモニアソーダ法)について、仕組み・覚え方のコツなどを含めてイラスト付きで解説していきます。
目次(タップした所へ飛びます)
ソルベー法(=アンモニアソーダ法)とは
ソルベーによって考案された、”炭酸ナトリウム”を工業的に効率よく・無駄なく製造する方法です。
炭酸ナトリウム\(\mathrm{Na_{2}CO_{3}}\)の用途
では、そもそもなぜ炭酸ナトリウムを作る必要があるのか、その特徴や用途をまとめておきましょう。
なんと言っても、ガラス製品への応用です。
特にソーダ石灰ガラスなどについては、「(作成中です):ケイ素とガラス/半導体などまとめ」で紹介します。
また、合わせてソーダ工業で重要となる「”NaOH”のイオン交換膜法による製法」についてもチェックしておきましょう。
ソルベー法の現在
反応の複雑さや様々な知識を問うことができるので、無機分野においては超頻出のアンモニアソーダ法ですが、実は現在はソルベー法が発明された時ほどメインの生産手段という訳ではありません。
トロナ石と言う鉱物から精製する方法など、その他の生産手段が増えたためです。
アンモニアソーダ法攻略のコツ
記事のはじめでも紹介し、このページにたどり着いて見てくださっている皆さんならばご存知の通り、とにかくソルベー法は覚えにくい・ミスしやすい・流れが分からなくなるものです。
この項では少しでもミスを減らし、しっかりと記憶するコツを解説します。
流れを確認して自分なりの図を作る
この記事だけでなく、教科書や参考書・問題集にもいろいろなフローチャートが載せてあります。
どれかを丸暗記するのではなく、参考にしながら「自分なりに理解しやすい図」を再構築してみましょう。
より覚えやすいチャートを作ろうと試行錯誤しているうちに、自然とソルベー法(とその反応)が頭に入ってきます。
そうする事で、ただ与えられた図を書き殴りのようにしているよりも効率的かつ忘れ辛くなります。
チャートで整理する(例付き)
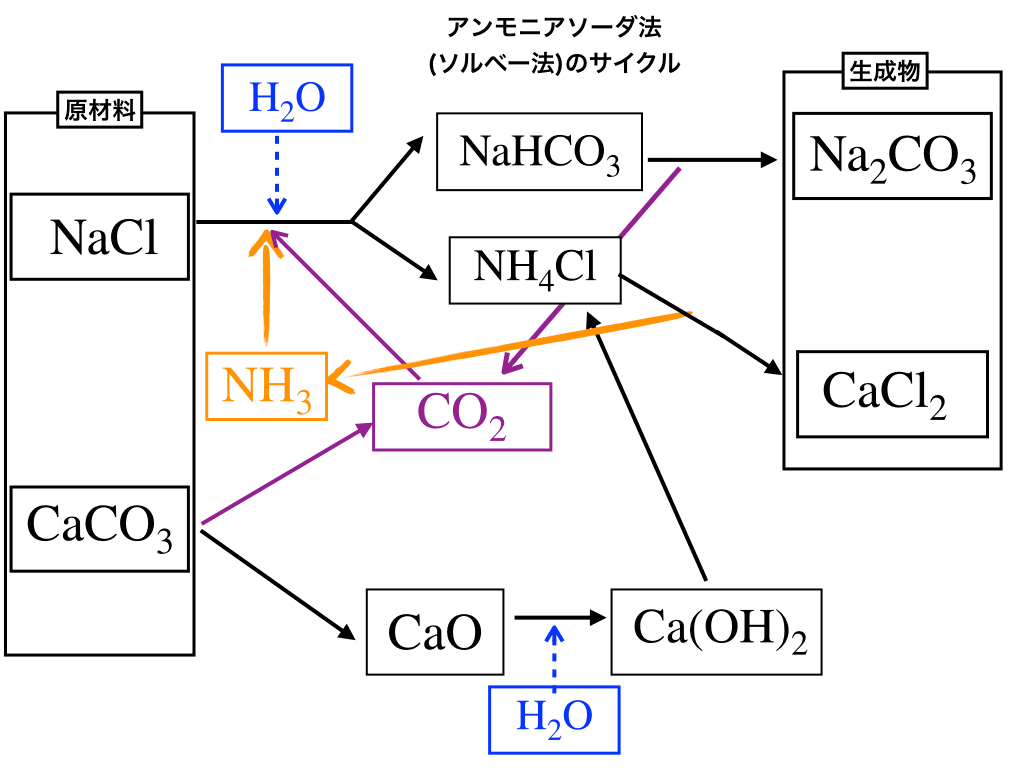
下の図はアンモニアソーダ法の流れを描いたもの(一例)です。
<ソルベー法のチャート1>
始点(原材料)と終点(生成物)の把握
かなり入り組んでいますが、ひとつひとつ要点を押さえていきましょう。
長い道のりですが、出発点と目的地を把握しておかないと途中で迷子になってしまいます。
始まり(=原材料)は【塩化ナトリウム】と【炭酸カルシウム】
共に海水や岩塩に含まれている\(\mathrm{NaCl、石灰石の成分であるCaCO_{3}}\)、とありふれている為、安価、かつ、楽に得ることができるので工業的には理想的な物質です。
目的地(=生成物)は【炭酸ナトリウム】、【塩化カルシウム】
これは\(\mathrm{Na_{2}CO_{3}}\)を作る為なので問題ないでしょう。
もう一つの生成物である\(\mathrm{CaCl_{2}}\)だけはしっかりと押さえておいてください。
各反応の整理
反応式の後にふっている(A〜E)と<チャート2>中の矢印にふっている(A〜E)が対応しています。
\(\mathrm{CaCO_{3}\underbrace{→}_{加熱}CaO+CO_{2}}\)・・・(A)
この過程では、炭酸カルシウムを熱分解する事で二酸化炭素と生石灰が出来ます。
※:ここで注意が必要なのが:生石灰= CaO、消石灰=\(\mathrm{Ca(OH)_{2}}\)です。どっちがどっちなのかよく混乱しがちなので、上手く覚えておきましょう。
(筆者は“消”石灰の“消”が【さんずいへん】→水→OHを含む→\(\mathrm{Ca(OH)_{2}}\)と覚えています。(と言うか何度も繰り返し触れていると自然に覚えてしまいますが・・・))
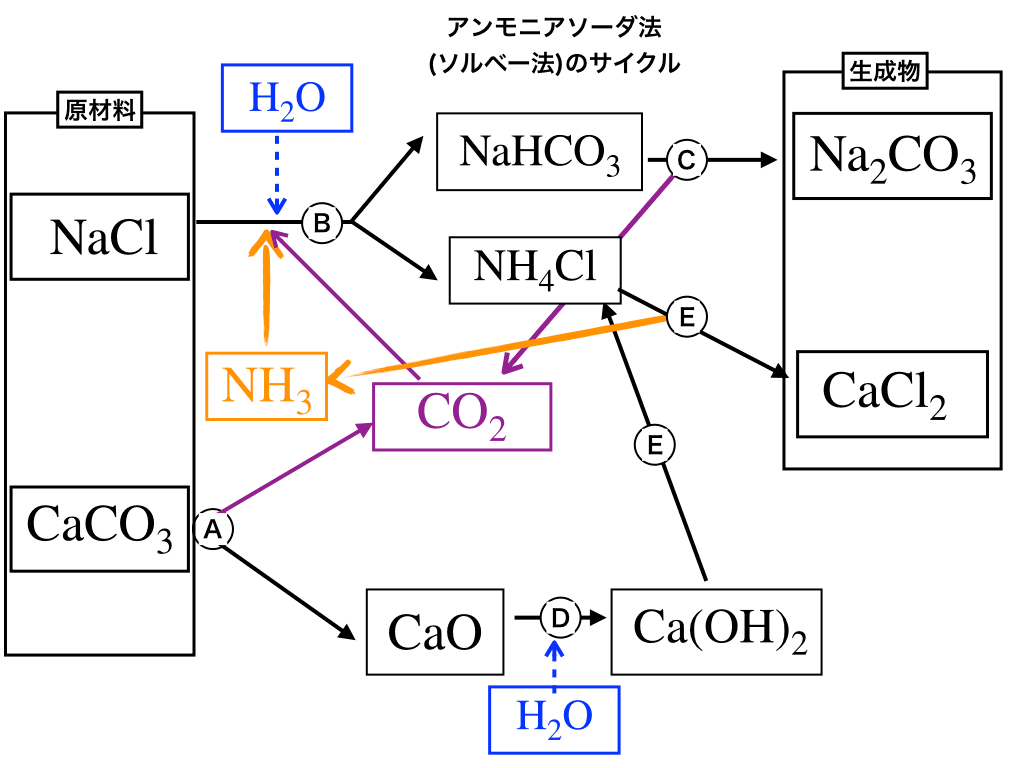
\(\mathrm{NH_{3}+H_{2}O+CO_{2}+NaCl→NaHCO_{3}+NH_{4}Cl}\)・・・(B*)
アンモニアを、『水と二酸化炭素を反応させて、炭酸にしたところ』へ注入します。
(これにより、中和反応が起きて”炭酸水素ナトリウム”と”塩化アンモニウム”が生成)
\(\mathrm{2NaHCO_{3}\underbrace{→}_{加熱}Na_{2}CO_{3}+H_{2}O+CO_{2}}\)・・・(C)
先ほど作った”炭酸水素ナトリウム”を加熱する事で、炭酸ナトリウム(これが目的でした)、水、二酸化炭素(後で再利用します)が生成されます。
\(\mathrm{ CaO+H_{2}O→Ca(OH)_{2}}\)・・・(D)
また、生石灰に水を加えることで消石灰(水酸化カルシウム)が出来ます。
この消石灰を次の工程へ生かします。
\(\mathrm{2NH_{4}Cl+Ca(OH)_{2}\underbrace{→}_{弱塩基遊離}2NH_{3}+CaCl_{2}+2H_{2}O}\)・・・(E**)
(B*):Bの反応は、『イオンの溶解度』の違いによって、反応が右に進む様になっています。(溶解度の記事で追記します。)
(E**):塩化アンモニウムに消石灰(強塩基)を加えると、【弱塩基遊離反応】によって、【アンモニアと塩化カルシウム+水】が生成されます。(これも次の項で説明する様に、再利用します)
再利用サイクルに注目する
再利用するのは<チャート1>中のオレンジ色と紫色で示した、アンモニア\(\mathrm{NH_{3}と二酸化炭素CO_{2}}\)です。
※:この項で用いる<チャート3>は、再利用する部分のみ残した物です。
二酸化炭素に注目
紫色のサイクルに着目すると、(B)で使う二酸化炭素は、「(A)の熱分解でできるもの」+「(C)で炭酸ナトリウムを生成した際に出来るもの」を再利用していることが見て取れます。
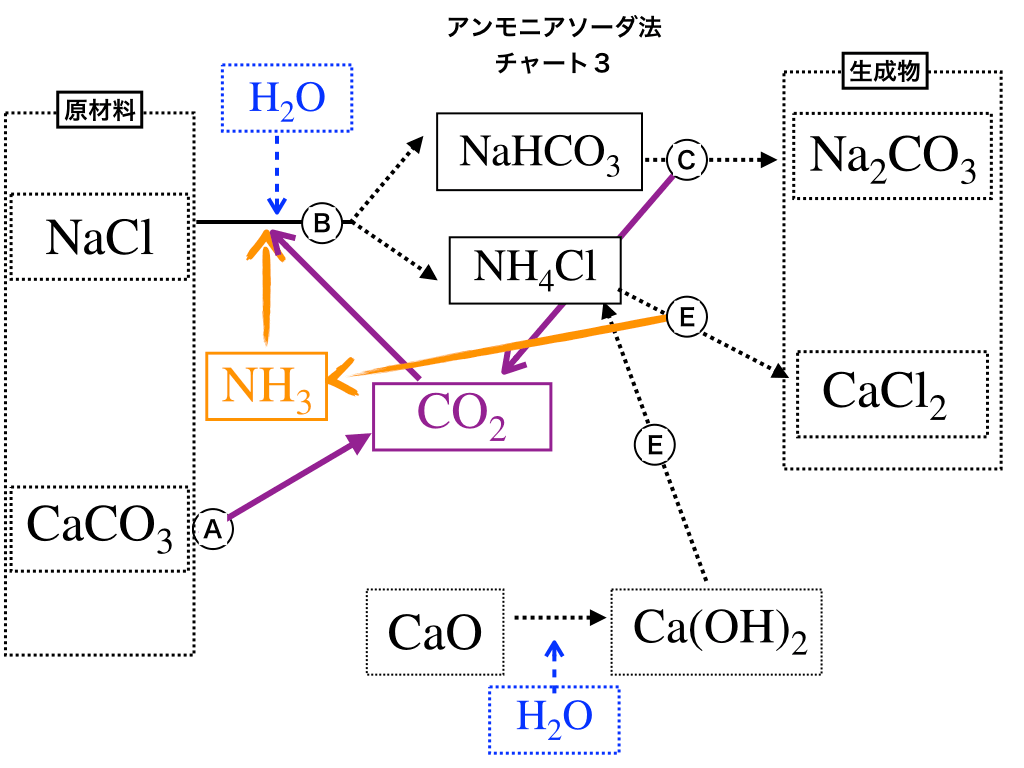
<チャート3:ソルベー法のサイクル>
アンモニアに注目
今度はオレンジ色のサイクルに着目します。
すると、(B)で用いるアンモニアは、(E)で生じる物を再び使用しています。
ここの2つのサイクルがとても重要なので、きっちりと自分なりのチャートを作っておきましょう。
ソルベー法まとめの式
上で紹介した(A)〜(E)までの各反応を全て(係数等も調整して)合わせると以下の(F)式になります。
\(\mathrm{2NaCl+CaCO_{3}\rightarrow Na_{2}CO_{3}+CaCl_{2}\cdots (F)}\)
炭酸ナトリウムの工業的製法の流れと覚え方まとめ
✔️自分なりの反応図を作ってみること。
✔️始点と終点、再利用する物質を把握
✔️弱塩基遊離反応など、必要に応じて理論化学を見直すこと。
工業的製法と無機化学の関連記事へ
>>『主な無機物質の工業的製法まとめ』<<

