錯イオンの意味/命名法/構造などまとめ
<記事の内容>:「配位結合と電子式の解説(1)」の続編として、金属イオンに非共有電子対が結合してできる『錯イオン』について、高校無機化学の範囲で覚えておくべきことをまとめています。
目次(タップした所へ飛びます)
錯イオンとは
まずはじめに、錯イオンに関係する用語をこの項でまとめ、次の項で詳しく掘り下げていきます。
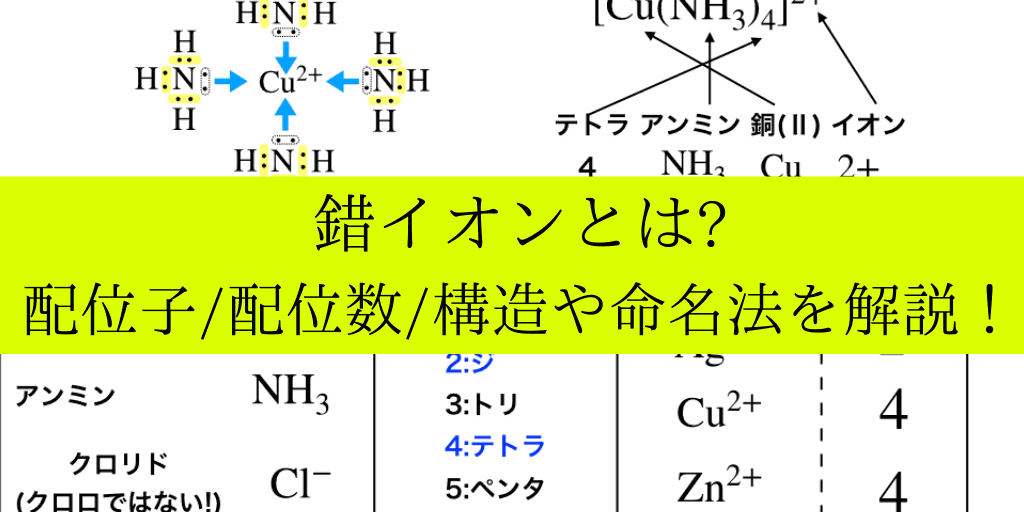
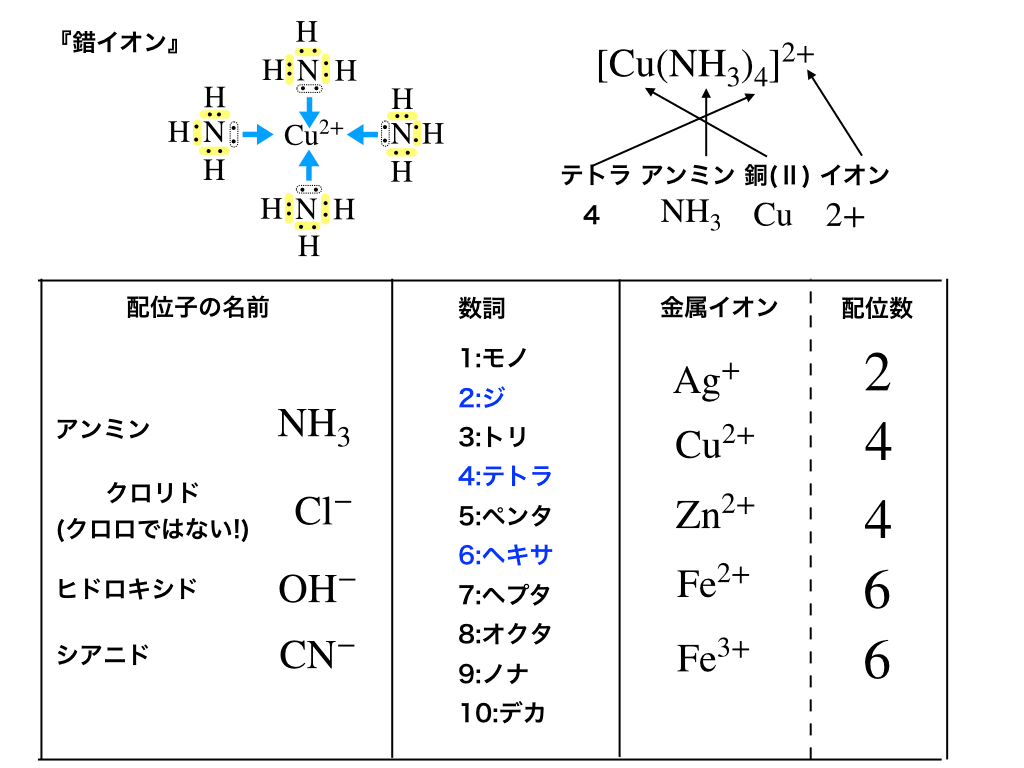
錯イオンは、下の図で紹介しているように(中心となる)”金属イオン”に、イオンや分子といった『配位子』が結合することによって出来るイオンのことを言います。
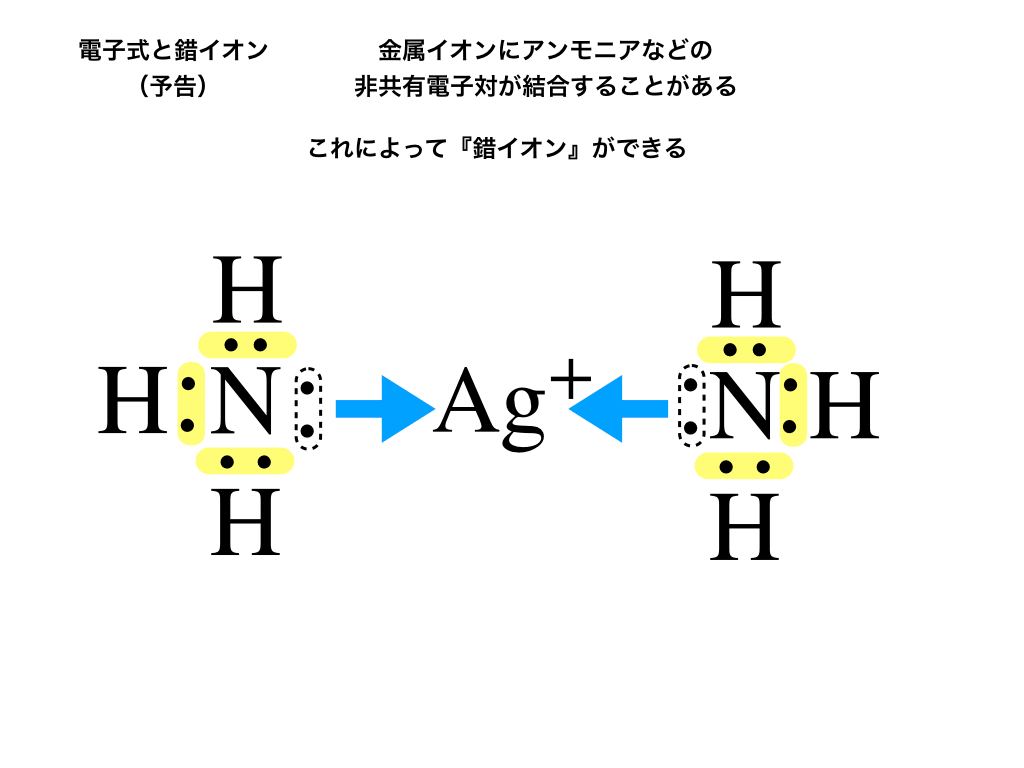
<ジアンミン銀⑴イオンの電子式の一部>
金属イオンの種類
錯イオンの中心となる金属イオンは(主に)6種類ほどがあり、それぞれに後述する『配位数』や『構造』が決まっています。
配位子とは
配位子とは、中心の金属イオンに非共有電子対がくっついていく『分子』や『イオン』のことです。
配位数とは
中心金属イオンが幾つの配位子と結合するか、その個数のことを『配位数』と呼びます。
錯イオンの構造と命名規則
では、ここから実際に配位数・配位子・数詞・中心に存在する金属、構造などを解説し覚える方法やコツを含めて紹介していきます。
<参考図:1>
金属イオンと配位数・構造
錯イオンの立体構造は、金属の種類と配位数で決まってきます。
・直線形→銀イオン
・正方形→銅イオン
・正四面体型→亜鉛イオン
上の2つはどちらも配位数が4ですが、錯イオンの構造が異なるので注意しましょう。
・正八面体型→鉄(\(\mathrm{Fe^{2+}とFe^{3+}}\)が両方存在するので要注意!)
錯イオンの例
錯イオンはそれぞれ一見複雑そうな名前になっています。
ex:(ジシアニド銀(Ⅰ)酸イオン)など
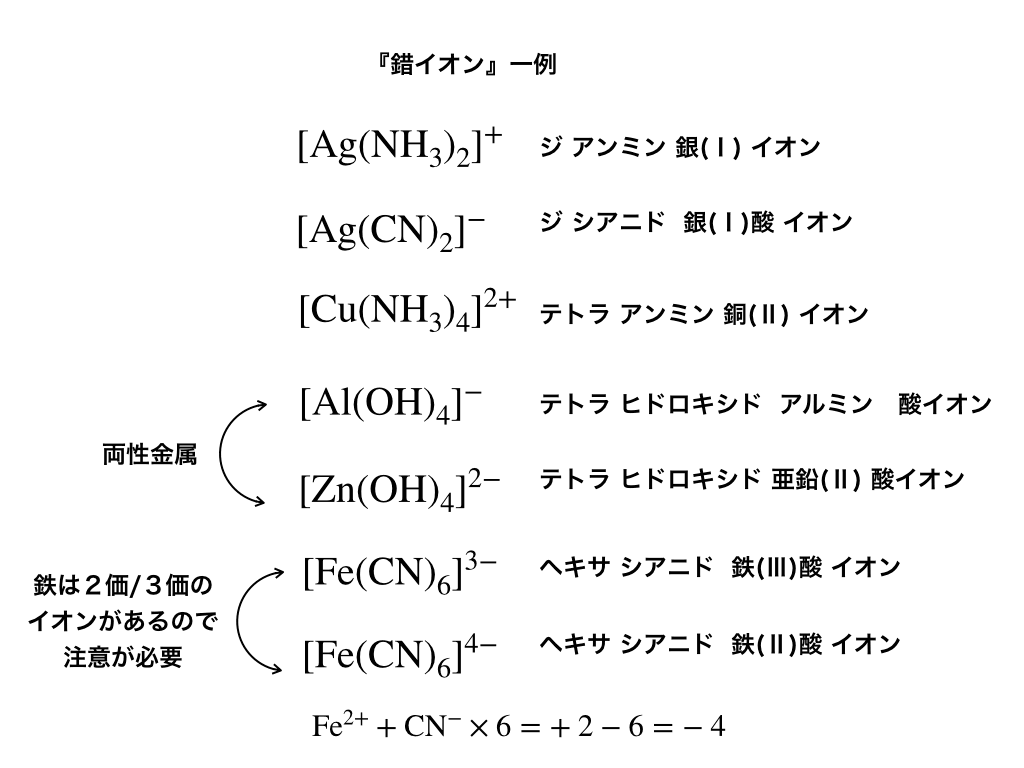
しかし、それらにはキチンとした命名規則があり、数種類の”ルール”を覚えてしまえば、あとは『組み合わせ』るだけで簡単に錯イオンの名前を決定(命名)することができます。
(『全部丸暗記』をするのは非常に効率が悪いので、”仕組み”を覚えてしまいましょう!)
命名法:手順まとめ
(1)まず、中心となる金属がとる配位数を覚えます。(ex:\(\mathrm{Cu^{2+}}\)→4)
(2)→そして、”数詞”と呼ばれているアラビア数字に対応する言葉を思い出し、(4→テトラ)
(3)→次に、”配位子”の名前(これは普段の名前と少し違うので、注意して覚える必要があります。) :
(\(\mathrm{NH_{3}}\)→『アンモニア』ではなく『アンミン』と呼びます。)
錯イオンの電荷による”酸”の付け方
(4)→最後に、配位子が持つ電荷と金属イオンがもともとの状態で帯びている電荷を計算します。
(\(\mathrm{Cu^{2+}は+2で、NH_{3}}\)はイオンではないので電荷が\(\pm 0 ,よって2+0\times 4=2\)
(5−1):結果が+であれば、『数詞+配位子名+金属名+イオン』 の順に並べると完成です!
例:(テトラ+アンミン+銅(Ⅱ)イオン)
(5−2):なお、電荷のトータルが負の時は『数詞+配位子名+金属名+”酸”+イオン』と、「酸」を付ける事を覚えておきましょう。
覚えておくべき数詞・配位子の名前
ここでは具体的な配位子と数詞をまとめておきます。
(上の表も参照しながら覚えていってください)
金属イオンと配位数一覧
金属イオンの配位数は、イオンの価数×2であることが多いです。
ただし、鉄Fe(ⅱ)のように6のこともある(参考:「鉄の工業的製法と酸化数の高炉での変化」)ので注意しておきましょう。
※鉄はイオンを含めて色々と特殊で覚えることが多いです
配位子一覧
主な配位子と名前、そしてそれぞれ注意しておきたいことをざっとまとめます。
\(\mathrm{NH_{3}}\):アンミン←この配位子は”イオン”ではない
\(\mathrm{Cl^{-}}\):クロリド←”クロロ〜(有機でよく使う)”としないように
\(\mathrm{CN^{-}}\):シアニド〜
\(\mathrm{OH^{-}}\):ヒドロキシド〜
\(\mathrm{S_{2}O_{3}^{2-}}\):チオスルファト〜←忘れやすい!
数詞1〜10まで
この数詞は、無機だけでなく有機でも頻繁に利用することになるので、1〜10までは最低限覚えておく必要があります。(できれば12まで)
しかし、高校範囲での錯イオンに限っては、出題される金属イオンがとる配位数が(2、4、6)くらいなので、使うのは基本的に上の表中で青字で強調している(ジ・テトラ・ヘキサ)の3つ程です。
錯イオンの色など(沈殿反応・錯塩の記事へ続く)
最後に紹介するのは錯イオンの色です。
これは覚えないと仕方がない部分があります。
(有機における『構造決定』が高校有機化学の集大成であるように)無機化学では、このイオンの色などを利用した、『イオンの系統分析(分離)』において最重要となるからです。
(この色の範囲については、錯塩などと合わせて覚えた方が良いため次回の記事で)セットで紹介します。
キレート錯体について(*ハイレベル)
最後に、次回の錯塩(錯体)の記事でも紹介しますが『キレート』という物質について説明をしておきます。
ここまでの配位子は、配位子1つが1つの配位結合を形成していました。
しかしながら、一個の配位子で複数の配位結合を生じるものがあり、まれに入試で出題されます。
『EDTA』、『クラウンエーテル』など、過去に東大で出題されたこともあり、注目を集めている分野(錯体化学)なのでハイレベル校・医歯薬系志望の方は一度概要だけでも頭に入れておきましょう。
錯イオンまとめ
・無機はどうしても記憶量が多くなりがちですが、その中でも錯イオン・錯塩は一番大変なところの一つです。
・ぜひ何度も(スキマ時間でも)読み返して、記憶を定着させるように頑張りましょう!
関連(続編)記事へ
前回:「電子式とイオン式、配位結合を解説」
今回:「(今ここです)」
次回:「炎色反応の覚え方と理論」
次次回:「金属イオンの沈殿反応/錯塩/化合物の色など」
無機の系統分析に必要な知識を上の記事でまとめています。
苦手な人が多いところなので、是非うまく活用して差をつけましょう!

