酸塩基の中和滴定・問題の解法
酸・塩基分野でも最重要である「中和滴定」について、
・計算問題の解き方、
・指示薬、
・滴定曲線から『pHジャンプ・中和点などの読み取り方』
まで、イラスト入りで詳しく解説しています。
(作成中:「シュウ酸による調整と実験器具まとめ」)
目次(タップした所へ飛びます)
中和滴定とは?(酸塩基反応)
中和滴定とは(適当な指示薬を用いて)、濃度・体積がわかっている酸or塩基に、濃度が不明の塩基or酸を滴下する事によって、(起きる“中和反応”を利用して)未知の値を求める(計算する)ことです。
具体例を次項から紹介していきます。
滴定曲線とpHジャンプ
例えば、”強酸”である硝酸に”弱塩基”の液体を少しずつ滴下して行くと、ある時点で(指示薬を使わないと目には見えませんが)急にpHが上昇します。
そして、弱塩基の滴下量が増えて行くにつれ、その塩基のpHの値に近づいていきます。
(参照;「水素イオン濃度とpHを解説」)
この急上昇する現象を”pHジャンプ”と呼び、『pHの値ー滴定量』をグラフにしたものを『滴定曲線』といいます。
強酸に(強・弱)塩基を滴下した時の滴定曲線
まずは強酸スタート、塩基を滴定していく際の滴定曲線を見てみましょう。
ここから4つのグラフを提示しますが、青色の丸で示した『中和点』がどこにあるかも大切なので、同時に確認しておきましょう。
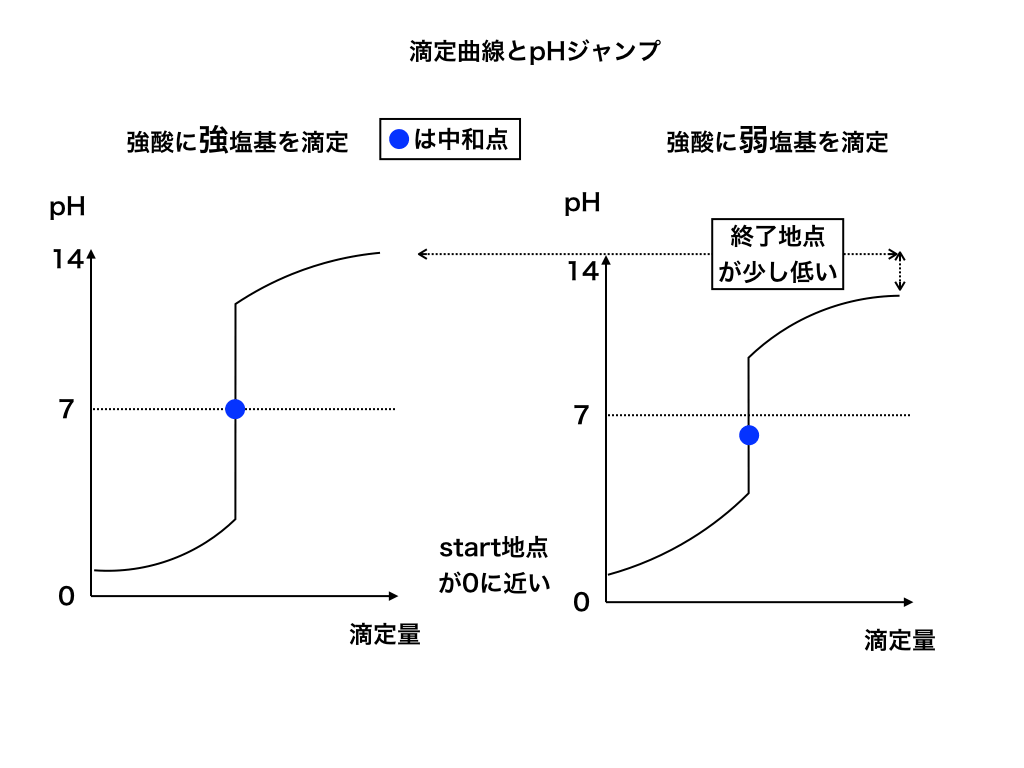
<図1>
上図のように、強酸からstartする場合は当然”pH値が低いところ”から始まり、滴定する塩基の強弱:強塩基(左)/弱塩基(右)によって上昇する値が変わります。
(最終的に滴定する(塩基)のpHに近づいていく)
弱酸に(強・弱)塩基を滴下した場合
つぎは弱酸スタートで、塩基を滴定していく2パターンの滴定曲線を見ていきます。
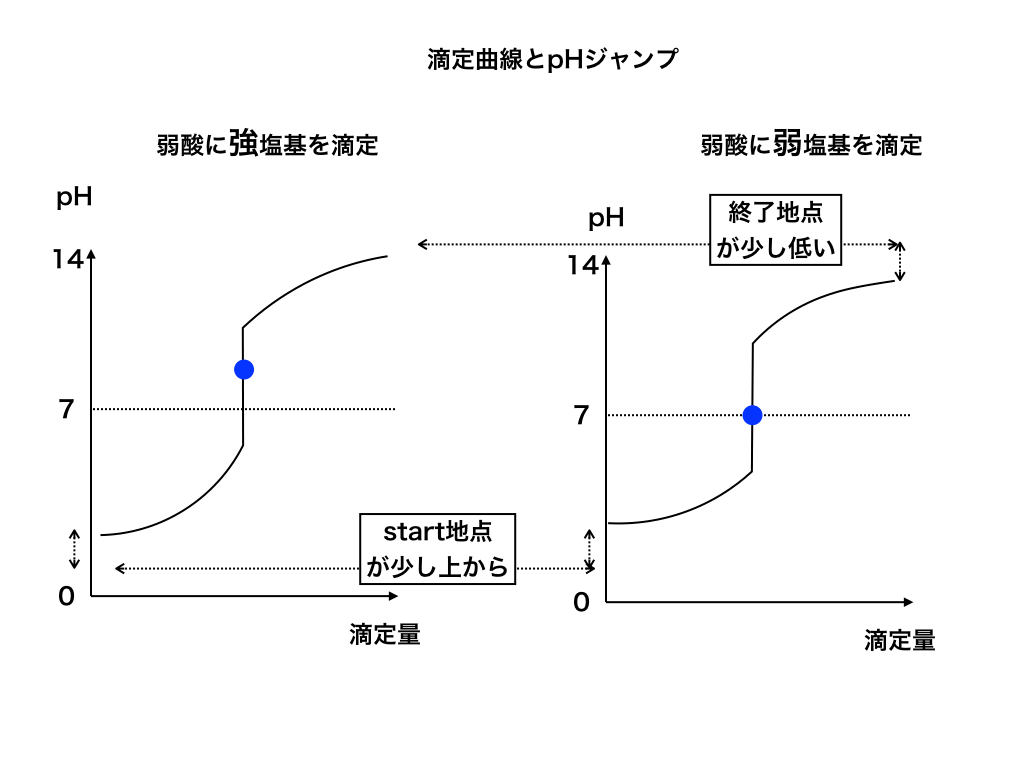
<図2>
同様に、弱酸からstartする場合はpHが高いところから始まり、滴定する塩基の強弱:強塩基(左)・弱塩基(右)によって上昇するpH値が変わります。
※:ここまでの<図1・図2>を見るとわかるように、中和点のpHは必ずしも7ではありません!よく間違えるポイントなので注意してください。
覚えておくべき指示薬/使い分け
pHジャンプを起こしたときの滴定量がわからないと、滴定によって濃度などを求める目的が果たせません。
そこで、”指示薬”を用いてその色の変化から中和するために必要だった酸や塩基の体積を調べます。
(「酸化・還元滴定」←のように、”酸化/還元の滴定の場合”には”指示薬の代わり”に、それ自体の色が変化する酸化剤\(\mathrm{MnO_{4}^{2-}}\)などを使います)
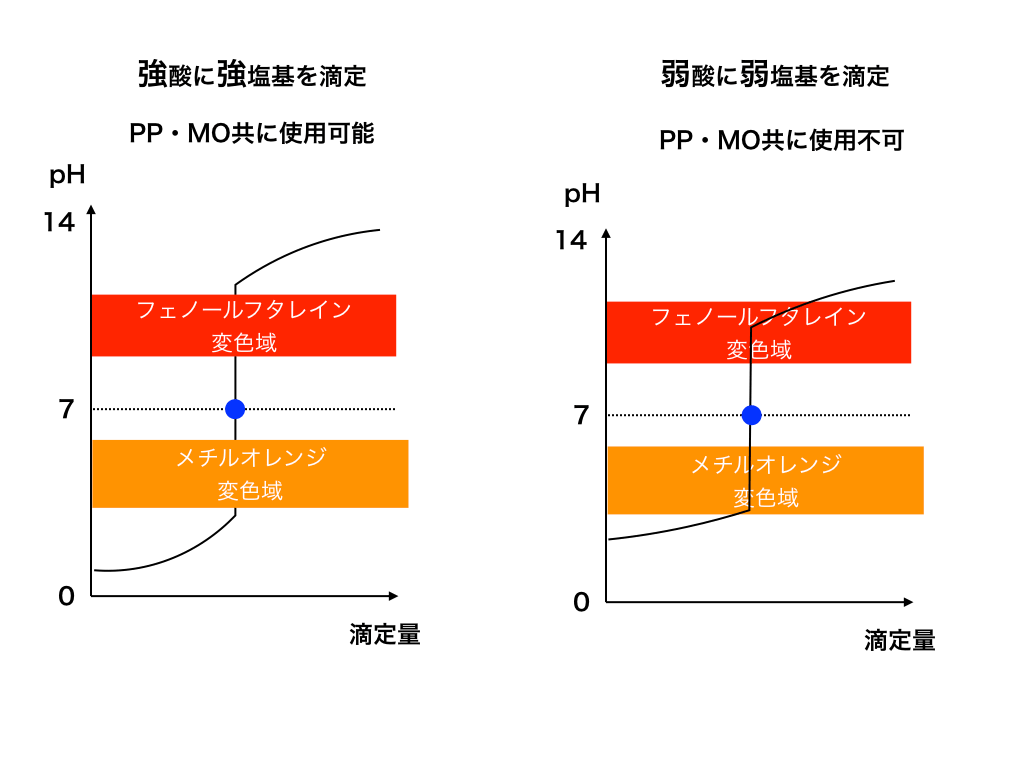
<図3>
PPの色と使う場合
”フェノールフタレイン”:PPは、有機化学を勉強している人ならば『フェノール』(Phenol)・『フタレ』(Phthalein)インという名前からどういう化合物かわかるかもしれません。
フェノール(ベンゼンにヒドロキシ基が結合したもの)に、『2分子の”無水フタル酸”が結合したもの』がその正体で、水素イオン濃度によってその構造が変わり、結果として色も変化します。
【変色域は:凡そ8.0〜9.9】
この値の幅が示すように、弱塩基を滴下する<図1と図2の右側のようなとき>には、「曲がっている部分」が変色域に含まれてしまう為、正確に中和に必要な体積が判別できないので使用できません。
メチルオレンジの色と使う場合
変色域は凡そ、3.0~4.5 (Methyl orange:MO)
先ほどと同じく変色域が原因で、弱酸に塩基を滴下していく場合<図1・図2の左側>、正確に中和した点を観察出来ないのでMOは使用不可です。
適切な指示薬がない(使えない場合)に注意
弱酸に弱塩基orその逆の滴定<図3の右>では、上の2種類の指示薬どちらを使用しても【変色域にpHジャンプを起こす前後の曲がっている部分】が被るので色が変化してしまいます。
これでは、中和を起こす滴下量を正確に観察できません。
すると、滴定によって未知の濃度などを求めることが不可能になってしまいます。
このような場合も存在するので、頭に入れておきましょう。
中和滴定の計算問題
では実際に計算問題の解き方と練習問題を見ていきましょう。
※:非常に重要なこと、かつ混乱しやすいところなので強調しておきますが、「電離度α」すなわち『酸や塩基の強弱』は中和反応に直接関係しません!
滴定問題で使う式は1つだけ
\(\mathrm{C_{A}\times V_{A}\times A_{価数}=C_{B}\times V_{B}\times B_{価数}}\)
この式の意味をひとつひとつ紹介していきます。
(尚、添え字のAはAcid(酸)・BはBase(塩基)の意味です。)
濃度
\(\mathrm{C_{Acid},C_{Base}}\)は滴下する・される水溶液のモル濃度を意味します。
詳しくは>>「溶液の濃度”3種類”をまとめて解説!」を参考にしてください。
体積
\(\mathrm{V_{Acid},V_{Base}}\)は滴定に使う酸・塩基それぞれの体積です。
価数
酸/塩基の『価数』とは、H:(酸の場合)もしくはOH:(塩基の場合)の数です。
ex:\(\mathrm{HNO_{3}なら1価、H_{2}CO_{3}}\)なら2価の酸
\(\mathrm{NaOHは1価、Ca(OH)_{2}}\)なら2価の塩基。
※:この価数自体についても、酸塩基の強弱とは直接の関係がないことに注意が必要です。
以上の3つの要素より
【酸側のこれらの3つを掛け合わせた値】
と
【塩基側の3つを掛け合わせた値】
が等しくなる時、中和されます。
(放出するプロトン\(\mathrm{H^{+}}\)とそれを受け取る\(\mathrm{OH^{-}}\)の物質量が等しくなるため。)
例題:未知の濃度を計算する
mol濃度0.2(mol/L)の硝酸50(ml)に、濃度不明の水酸化Naを20(ml)滴下すると指示薬である〇〇が変色した。
このとき、\(\mathrm{Na(OH)}\)の濃度を求めよ。また、〇〇に適する指示薬はMO・PPのどちらが適当か?あわせて答えよ。
解答と解説
\(\mathrm{0.2\times 0.050\times 1=C_{X}\times 0.020\times 1}\)
よって、NaOHの濃度は
0.5(mol/L)・・・(答)
次に指示薬についての設問ですが、わざとひっかけ問題のようにしました。
(PPとMOで悩む必要はありません。解説は以下↓)
この滴定では強酸スタート→強塩基で中和反応を起こしているため、滴定曲線は<図3ー左>の様になり、使う試薬は「どちらでもOK」です。
(たまに、しっかり理解しているかどうかを試す目的でこう言った質問をされる事があります。落ち着いて「どちらでも可」と答えられるようになっておきましょう!)
酸塩基の中和滴定まとめ
今回は中和反応・滴定の基本を扱ってきました。
このレベルをクリアしないと、更に複雑な『”逆”滴定や”二段階”滴定』などの更にややこしい問題に取りかかれないので、非常に重要です。
しっかりと復習して、身に付けておきましょう。
関連記事へ
次回予告:「(作成中です):滴定(Ⅱ)”逆”滴定と”二段階”滴定の意味+計算問題」

